Seyeon Oh 1, Je Hyuk Lee 2 3, Hyoung Moon Kim 3, Sosorburam Batsukh 1 3, Mi Jeong Sung 4, Tae Hwan Lim 4, Myoung Hoon Lee 4, Kuk Hui Son 5, Kyunghee Byun 1 3 6
Thông tin tác giả: Phòng thí nghiệm mạng lưới tế bào chức năng, Viện ung thư và tiểu đường Lee Gil Ya, Đại học Gachon, Incheon 21999, Hàn Quốc
Mã số PMC: PMCID: PMC10177436
Tóm tắt
Chất làm đầy axit poly-L-lactic (PLLA) điều chỉnh tình trạng mất thể tích da bằng cách kích thích nguyên bào sợi tổng hợp collagen và tăng thể tích. PLLA kích hoạt nguyên bào sợi tiết ra yếu tố tăng trưởng chuyển dạng-β (TGF-β) do đại thực bào gây ra. Tuy nhiên, liệu phân cực đại thực bào M2 có liên quan đến quá trình tổng hợp collagen do PLLA gây ra thông qua hoạt hóa nguyên bào sợi ở da lão hóa hay không vẫn chưa được biết. Do đó, chúng tôi đã đánh giá tác dụng của PLLA đối với quá trình tổng hợp collagen ở da thông qua phân cực M2 trong mô hình lão hóa tế bào do H2O2 gây ra và da động vật lão hóa. Các đại thực bào được xử lý bằng H2O2 có mức độ biểu hiện tăng của dấu hiệu M1 CD80 và giảm mức độ biểu hiện của dấu hiệu M2 CD163, những yếu tố này đã được PLLA đảo ngược. Mức độ biểu hiện của interleukin (IL)-4 và IL-13, là những chất trung gian phân cực M2, đã giảm ở các đại thực bào được xử lý bằng H2O2 và tăng lên sau khi xử lý bằng PLLA. Mức độ biểu hiện CD163, IL-4 và IL-13 giảm ở da lão hóa, nhưng tăng lên sau khi điều trị bằng PLLA. Mức độ biểu hiện của TGF-β, pSMAD2/SMAD2, yếu tố tăng trưởng mô liên kết (CTGF), actin cơ trơn alpha (α-SMA), collagen loại 1A1 (COL1A1) và COL3A1 cũng giảm ở da lão hóa, nhưng tăng lên sau khi điều trị bằng PLLA. Hơn nữa, PLLA điều hòa tăng tín hiệu phosphatidylinositol 3-kinase p85α (PI3-kinase p85α)/protein kinase B (AKT), dẫn đến tăng sinh nguyên bào sợi. PLLA làm giảm biểu hiện của matrix metalloproteinase (MMP) 2 và MMP3, là những chất phá hủy các sợi collagen và elastin ở da lão hóa. Lượng sợi collagen và elastin ở da lão hóa tăng lên sau khi điều trị bằng PLLA. Tóm lại, PLLA gây ra sự phân cực M2 bằng cách tăng mức độ IL-4 và IL-13 và điều hòa tăng biểu hiện TGF-β và tổng hợp collagen ở da lão hóa.
Từ khóa: axit poly-L-lactic ; lão hóa ; phân cực M2 ; tổng hợp collagen và elastin
1. Giới thiệu
Lão hóa gây ra nhiều thay đổi khác nhau ở da, bao gồm nếp nhăn, teo cơ, đàn hồi và mất thể tích dưới da [1 , 2 ]. Chất làm đầy da có thể dễ dàng và đơn giản để điều chỉnh tình trạng mất thể tích [ 3 ]. Do đó, sự quan tâm đến việc sử dụng chất làm đầy da để trẻ hóa da mà không cần phẫu thuật đã tăng nhanh chóng [4 , 5 , 6 ]. Vật liệu làm đầy có nguồn gốc tự nhiên từ động vật hoặc vật liệu tổng hợp. Các vật liệu làm đầy tổng hợp thường được sử dụng bao gồm canxi hydroxyapatite, polymethyl methacrylate, axit poly-L-lactic (PLLA) và silicone [7 ]. Tính tương thích sinh học của PLLA, một loại polyme phân hủy sinh học, đã được chứng minh trong y học từ lâu như một thành phần của nhiều vật liệu phẫu thuật khác nhau, bao gồm chỉ khâu, đinh, ghim, vít và nẹp phẫu thuật [8 , 9 ].Chất làm đầy PLLA được tiêm vào da cùng với dung dịch mang sẽ ngay lập tức làm tăng thể tích tại vị trí tiêm, thể tích này sẽ nhanh chóng biến mất khi dung dịch mang được mô hấp thụ [10 ]. Các hạt PLLA còn lại bị phân hủy thành axit lactic, giúp tăng cường tổng hợp collagen bởi nguyên bào sợi và dần dần làm tăng độ dày của da [11 ]. Các tế bào miễn dịch nhận ra PLLA là một vật lạ và các phản ứng viêm, vật lạ dưới lâm sàng có thể gây ra quá trình tổng hợp collagen do PLLA gây ra [12 , 13 ]. Trong quá trình phản ứng với vật lạ, sự hấp phụ của protein huyết tương vào vật lạ trong máu sẽ khởi tạo quá trình tuyển dụng các tế bào đơn nhân và các tế bào đơn nhân biệt hóa thành đại thực bào, sau đó làm tăng mức độ bám dính của đại thực bào [14 ]. Sau đó, các tế bào miễn dịch này hình thành các tế bào khổng lồ, kích thích quá trình tuyển dụng nguyên bào sợi và hình thành mô xơ hóa [ 14 ]. Đại thực bào đóng vai trò quan trọng trong quá trình tổng hợp collagen do PLLA gây ra bằng cách tiết ra nhiều loại cytokine khác nhau, chẳng hạn như interleukin (IL)-1, IL-6, IL-8, yếu tố tăng trưởng chuyển dạng beta (TGF-β) và yếu tố hoại tử khối u alpha (TNF-α). Các cytokine này tham gia vào quá trình phân hủy vật liệu sinh học và tái tạo mô [15 ]. Các mô xung quanh vị trí tiêm PLLA tích tụ đại thực bào CD68+ và nguyên bào sợi CD90+. Chúng cũng làm tăng mức TGF-β1 và chất ức chế mô của metalloproteinase 1 (TIMP1), thúc đẩy sự lắng đọng collagen I và III [16 ].Đại thực bào được phân loại thành hai phân nhóm: M1 và M2 [17 , 18 ]. Đại thực bào M1 bảo vệ chống lại vi khuẩn hoặc vi-rút và được kích hoạt bởi nhiều kích thích gây viêm khác nhau, bao gồm interferon-gamma, yếu tố kích thích khuẩn lạc đại thực bào hạt và lipopolysaccharides. Chúng tiết ra nhiều cytokine gây viêm khác nhau, chẳng hạn như IL-1, IL-6, IL-12 và IL-23 [18 , 19 ]. Đại thực bào M2 được kích hoạt bởi IL-4 và IL-13 và tham gia vào quá trình xơ hóa và tái tạo mô bằng cách tiết ra IL-10 và TGF-β [20 , 21 ]. Trước đây, chúng tôi đã báo cáo về mức độ biểu hiện dấu hiệu M1 tăng lên và mức độ biểu hiện dấu hiệu M2 giảm xuống ở da động vật già so với da động vật non [22 ]. Hơn nữa, mức độ biểu hiện của các cytokine tiền viêm (ví dụ, TNF-α) cao hơn và mức độ của các cytokine chống viêm (ví dụ, IL-10) thấp hơn ở da già so với mức độ của chúng ở da động vật non [22 ].Matrix metalloproteinase (MMP) phá hủy các sợi collagen và elastin trong da, gây ra nếp nhăn [23 , 24 ]. Mức độ biểu hiện của MMP2, MMP3 và MMP9 cao hơn ở da động vật già so với da động vật non [22 ]. Số lượng và chức năng của nguyên bào sợi da cũng giảm trong quá trình lão hóa [25 , 26 ]. Nguyên bào sợi lão hóa có khả năng tăng sinh giảm và tiết ra nhiều protein phân hủy ma trận ngoại bào (ECM) hơn như MMP và cytokine tiền viêm [26 ]. Hơn nữa, nguyên bào sợi già sản xuất ít sợi collagen và elastin hơn [27 ].Các nghiên cứu trước đây đã chỉ ra tác động của chất độn PLLA lên quá trình tổng hợp collagen, chủ yếu ở động vật non [28 , 29 , 30 ]. Tuy nhiên, các báo cáo được mô tả ở trên cho thấy chức năng của đại thực bào và nguyên bào sợi trong phản ứng dị vật dưới lâm sàng với chất độn PLLA có thể khác nhau khi PLLA được tiêm vào da già. Do đó, chúng tôi đã đánh giá tác động của chất độn PLLA lên quá trình tổng hợp collagen ở da chuột già. Chúng tôi đưa ra giả thuyết rằng PLLA gây ra phân cực M2 và đại thực bào M2 đã làm tăng mức IL-10 và TGF-β, dẫn đến tổng hợp collagen và giảm mức MMP ở da già.
2. Vật liệu và phương pháp
2.1. Chuẩn bị PLLA
2.1.1. Tổng hợp PLLA
L-lactide (18 g, 0,12 mol) (Corbion, Amsterdam, Hà Lan), 0,09 mL stannous octoate (Sigma-Aldrich, St. Louis, MO, Hoa Kỳ) và 0,54 g (0,003 mol) chất khởi đầu 1-dodecanol (Sigma-Aldrich) được đặt trong lò phản ứng có hai lớp vỏ 1 L ở nhiệt độ phòng. Sau khi loại bỏ oxy và độ ẩm, nitơ được đưa vào lò phản ứng trong 5 phút. Hỗn hợp được đun nóng dần đến 120 °C trong 1 giờ, sau đó khuấy ở 120 °C trong 4 giờ. PLLA tổng hợp được thu thập thông qua quá trình lọc chân không và các chất không phản ứng được loại bỏ bằng etanol. PLLA được hòa tan ở nhiệt độ phòng trong 220 mL dichloromethane (99,5%; Samchun Chemical Co., Ltd., Seoul, Hàn Quốc). Dung dịch PLLA được pha loãng bằng cách nhỏ từng giọt chậm 320 mL polyvinyl alcohol 1% (87–90%, mol wt 30.000–70.000; Sigma-Aldrich) bằng pipet thủy tinh trong khi khuấy ở tốc độ 2000 vòng/phút bằng máy trộn cắt. Dung dịch được lọc trong điều kiện chân không trong 3 giờ ở nhiệt độ phòng và ly tâm ở tốc độ 3000 vòng/phút trong 10 phút ở nhiệt độ phòng để tách PLLA. Sau khi loại bỏ phần chất lỏng trong, polyvinyl alcohol còn lại trong PLLA được phân tán lại trong 50 mL nước cất và ly tâm ở tốc độ 3000 vòng/phút trong 10 phút ở nhiệt độ phòng. Cuối cùng, polyme PLLA thu được bằng cách sấy khô trong lò ở nhiệt độ 45 °C trong 24 giờ [31 , 32 , 33 , 34 ].
2.1.2. Chụp ảnh bằng kính hiển vi điện tử quét (SEM) để quan sát bề mặt PLLA
PLLA bị phân hủy sinh học trong ống nghiệm trong 1, 2, 3 và 4 tuần ở 50 °C. Vì chụp ảnh SEM khó ở trạng thái dung dịch, bột PLLA và dịch nổi được tách ra sau khi phân hủy sinh học. Bột PLLA được sấy khô ở 45 °C trong 24 giờ. Đối với SEM, bột PLLA (25 mg) được gắn trên các đầu SEM bằng băng đồng dẫn điện, sau đó phủ platin ở mức 30 mW trong 180 giây trong môi trường khí argon. Bề mặt được quan sát ở điện áp AC 15 kV ở nhiệt độ phòng bằng kính hiển vi điện tử quét (Carl Zeiss, Jena, Đức).
2.2. Mô hình thực nghiệm
2.2.1. Xử lý PLLA trong đại thực bào già do H 2 O 2 gây ra
Đại thực bào chuột (tế bào RAW 264.7, Ngân hàng tế bào Korea, Seoul, Hàn Quốc) được nuôi cấy và duy trì trong môi trường Dulbecco’s Modified Eagle Medium (HyClone-Cytiva, Marlborough, MA, Hoa Kỳ) chứa 10% huyết thanh bò thai nhi (FBS; Gibco-Thermo Fisher Scientific, Rockford, IL, Hoa Kỳ) và 1% penicillin/streptomycin (P/S; Welgene, Gyeongsan, Hàn Quốc) trong tủ ấm 37 °C với 5% CO2 . Sự lão hóa được gây ra bằng cách xử lý đại thực bào với 100 μM H2O 2 trong 2 giờ. Các tế bào được rửa bằng dung dịch đệm phosphate Dulbecco (DPBS), sau đó ủ trong môi trường tăng trưởng trong 72 giờ. Tế bào già và không già được xử lý bằng dung dịch đệm phosphat (PBS) hoặc PLLA 200 μg/mL (SACCI Bio Co., Seoul, Hàn Quốc) trong 48 giờ. Sau khi xử lý, dịch ly giải tế bào được thu thập bằng dụng cụ cạo tế bào và dịch nổi (môi trường được xử lý; CM) được ly tâm để loại bỏ các tế bào nổi (Hình S1 ) và cô đặc bằng ống Amicon (Merck Millipore, Burlington, MA, Hoa Kỳ) ở tốc độ 4000×g trong 40 phút ở nhiệt độ phòng. Các đại thực bào được sử dụng trong nghiên cứu này được truyền qua 12–15 lần và mô hình trong ống nghiệm được tạo ra khi các tế bào đạt độ hợp lưu khoảng 80%.
2.2.2. Xử lý PLLA đối với nguyên bào sợi già do H2O 2 gây ra
Nguyên bào sợi người (CCD-986sk; Bộ sưu tập nuôi cấy loại Mỹ, Manassas, VA, Hoa Kỳ) được nuôi trong môi trường Dulbecco cải tiến của Iscove (Welgene), 10% FBS (Gibco-Thermo Fisher Scientific) và 1% P/S (Welgene) trong tủ ấm 37 °C với 5% CO2. Sự lão hóa được gây ra bằng cách xử lý nguyên bào sợi với 350 μM H2O2 Trong1,5 giờ. Các tế bào được rửa bằng DPBS, sau đó ủ trong môi trường tăng trưởng mới trong 72 giờ để gây ra sự lão hóa [35 ]. Nguyên bào sợi lão hóa và không lão hóa được xử lý bằng PBS hoặc 200 μg/mL PLLA trong 48 giờ (Hình S2 ). Sau khi xử lý, dịch phân hủy tế bào được thu thập bằng dụng cụ cạo tế bào để phân tích protein. Các nguyên bào sợi được sử dụng trong nghiên cứu này được cấy truyền 7–9 lần và mô hình trong ống nghiệm được tạo ra khi các tế bào đạt độ hợp lưu khoảng 70%.
2.2.3. Điều trị nguyên bào sợi già bằng CM từ đại thực bào già được điều trị bằng PLLA
Sự lão hóa của nguyên bào sợi được gây ra bằng H2O2 , như mô tả trong Mục 2.2.2 . Các nguyên bào sợi già và không già được xử lý bằng CM thu thập được trong Mục 2.2.1 . trong 48 giờ (Hình S3 ). Sau đó, các chất phân hủy tế bào được thu thập bằng dụng cụ cạo tế bào. Các nguyên bào sợi được sử dụng trong nghiên cứu này được truyền 7–9 lần và mô hình trong ống nghiệm được tạo ra khi các tế bào đạt độ hợp lưu khoảng 70%.
2.2.4. Điều trị PLLA ở chuột già và chuột trẻ
Nghiên cứu này đã được hội đồng đạo đức của Trung tâm Chăm sóc và Sử dụng Động vật chấp thuận và được tiến hành theo Ủy ban Chăm sóc và Sử dụng Động vật của Viện tại Đại học Gachon (số phê duyệt LCDI-2021-0172). Chuột C57BL/6 đực và cái sáu tuần tuổi được mua từ Orient Bio (Seongnam, Hàn Quốc). Sau một tuần thích nghi, những con chuột được giao phối và những chú chuột con được nuôi trong 2–14 tháng trong điều kiện nhiệt độ được kiểm soát (22 ± 5 °C), độ ẩm tương đối (50 ± 10%) và chu kỳ sáng-tối 12 giờ. Chúng được tiếp cận miễn phí với chế độ ăn uống và nước tiêu chuẩn trong phòng thí nghiệm.Chuột được phân vào nhóm trẻ và nhóm già để có thể lấy mẫu da ở tuần thứ 13 và tháng thứ 14. Trong mỗi nhóm tuổi, chuột được chia ngẫu nhiên thành các nhóm điều trị (n = 3/nhóm điều trị/thời điểm). Nước muối hoặc PLLA 10 mg/mL (100 μL) được tiêm vào lớp hạ bì tại năm vùng khác nhau trên lưng chuột (5 cm × 5 cm) và mô da được thu thập dưới gây mê bằng isoflurane (HANA Pharm Co., Ltd., Seoul, Hàn Quốc) sau 1, 3 và 28 ngày sau khi cạo lông ở các vị trí tiêm (Hình S4 ).
2.3. Hoạt động của β-Galactosidase liên quan đến lão hóa (SA-β-gal)
Các tế bào dương tính với SA-β-gal được phát hiện bằng bộ dụng cụ nhuộm SA-β-gal (Công nghệ truyền tín hiệu tế bào, Danvers, MA, Hoa Kỳ). Các tế bào được gieo vào các đĩa 6 giếng. Như đã mô tả trong Phần 2.2.1 ,Phần 2.2.2 và Phần 2.2.3 , ba loại mô hình trong ống nghiệm đã được thiết lập. Sau khi rửa bằng PBS, các tế bào được cố định trong dung dịch cố định trong 15 phút ở nhiệt độ phòng. Sau khi rửa bằng PBS, các tế bào được nhuộm bằng dung dịch nhuộm β-gal ở 37 °C trong 24 giờ. Đối với phân tích thống kê, 2000 tế bào đã được đếm cho mỗi phân tán tế bào từ tất cả các nhóm thử nghiệm theo bộ ba.
2.4. Phương pháp Western Blotting
Tế bào và mô da bị phá vỡ bằng đệm thử nghiệm kết tủa miễn dịch phóng xạ có chứa chất ức chế protease và phosphatase (bộ dụng cụ phá vỡ EzRIPA; TaKaRa, Tokyo, Nhật Bản). Sau khi siêu âm, các mẫu được ly tâm ở tốc độ 14.000 × g trong 15 phút ở 4 °C. Nồng độ protein được xác định bằng cách sử dụng thử nghiệm axit bicinchoninic (Thermo Fisher Scientific). Lượng protein bằng nhau được tách ra bằng điện di gel polyacrylamide-natri dodecyl sulfat 8–12% và chuyển sang màng polyvinylidene fluoride (PVDF) đã được hoạt hóa trước bằng methanol. Màng PVDF bị chặn bằng sữa tách béo 5% ở nhiệt độ phòng để ngăn chặn sự liên kết của các protein không đặc hiệu. Sau đó, màng được ủ với kháng thể chính pha loãng thích hợp (Bảng S1 ) ở 4 °C qua đêm. Màng được rửa bằng dung dịch đệm tris có chứa 0,1% Tween 20 và ủ với kháng thể thứ cấp ở nhiệt độ phòng trong 1 giờ. Các dải protein được hình dung bằng dung dịch phát quang hóa học tăng cường (Cytiva) sử dụng LAS-4000 (Bio-Rad, Hercules, CA, Hoa Kỳ). Các giá trị biểu hiện protein riêng lẻ được định lượng bằng phần mềm Image J (Viện Y tế Quốc gia, NIH, Maryland, MD, Hoa Kỳ) và được chuẩn hóa theo beta-actin (Công nghệ Tín hiệu Tế bào) để kiểm soát sự khác biệt trong tải lượng protein. Các giá trị cho một blot đơn được thể hiện theo giá trị trung bình của nhóm đầu tiên.
2.5. Xét nghiệm miễn dịch liên kết với enzyme (ELISA)
Một tấm 96 giếng được tráng bằng dung dịch tráng chứa 0,6% natri bicarbonate (Sigma-Aldrich) và 0,3% natri cacbonat (Sigma-Aldrich) trong nước cất ở 4 °C qua đêm. Tấm được chặn trong 4 giờ ở nhiệt độ phòng bằng cách sử dụng 5% sữa tách béo. Sau khi rửa bằng PBS chứa 0,1% Tween 20 (TPBS), các mẫu protein được phân lập bằng bộ dụng cụ ly giải EzRIPA (TaKaRa) được thêm vào tấm, được ủ ở 4 °C trong 24 giờ. Sau khi rửa bằng TPBS, tấm được ủ qua đêm với các kháng thể chính ở 4 °C ( Bảng S1 ). Sau khi rửa tấm, tấm được ủ với các kháng thể thứ cấp liên hợp với peroxidase cải ngựa ở nhiệt độ phòng trong 2 giờ. Sau khi rửa, các mẫu được ủ với 3,3′,5,5′-tetramethylbenzidine (Sigma-Aldrich) trong 15 phút để phát triển màu. Các phản ứng được dừng lại với thể tích bằng nhau của 2 MH2 SO4 và độ hấp thụ được đo ở 450 nm bằng máy đọc đĩa ELISA (Multiskan SkyHigh Photometer; Thermo Fisher Scientific).
2.6. Miễn dịch tế bào học
Tế bào được gieo vào các phiến kính buồng Lab-Tek II 8 giếng (Nunc, St. Louis, MO, Hoa Kỳ). Các tế bào không lão hóa hoặc bị lão hóa được xử lý bằng PLLA trong 48 giờ. Các tế bào được rửa bằng PBS và cố định bằng paraformaldehyde 4% lạnh (Sigma-Aldrich) ở nhiệt độ phòng trong 15 phút. Các phiến kính được ủ với huyết thanh bình thường (Vector laboratories, Newark, CA, Hoa Kỳ) trong 1 giờ để ngăn chặn liên kết không đặc hiệu, sau đó được ủ với các kháng thể chính (Bảng S1 ) ở 4 °C trong 24 giờ. Sau khi rửa bằng PBS, các phiến kính được ủ với các kháng thể thứ cấp (Invitrogen, Waltham, MA, Hoa Kỳ) ở nhiệt độ phòng trong 1 giờ trong bóng tối. Sau khi rửa, nhân tế bào được nhuộm màu đối lập với 4′,6-diamidino-2-phenylindole (DAPI; Sigma-Aldrich). Các tấm kính được gắn bằng dung dịch gắn Vectashield (phòng thí nghiệm Vector) và hình ảnh huỳnh quang được thu thập bằng kính hiển vi cộng hưởng (Carl Zeiss 710) tại Cơ sở cốt lõi để chụp ảnh tế bào đến in vivo. Hình ảnh cộng hưởng được chụp ngẫu nhiên để phân tích hình ảnh và cường độ huỳnh quang được phân tích bằng phần mềm ZEN 2009 (Carl Zeiss).
2.7. Nhuộm bằng 3,3-Diaminobenzidine (DAB)
Các mô da cố định bằng paraformaldehyde được chuẩn bị bằng cách sử dụng bộ xử lý mô (Sakura Seiki Co., Ltd., Tokyo, Nhật Bản) và một thiết bị nhúng (Sakura Seiki Co., Ltd.) được cắt bằng máy cắt vi thể (Thermo Fisher Scientific) ở độ sâu 5 μm. Thu hồi kháng nguyên được thực hiện bằng đệm natri citrat (pH 6). Sau khi rửa bằng PBS, các lát cắt được chặn bằng huyết thanh bình thường (Vector Laboratories) trong 1 giờ ở nhiệt độ phòng để ngăn ngừa liên kết không đặc hiệu. Sau khi chặn, các lát cắt được ủ với kháng thể chính (Bảng S1 ) qua đêm ở 4 °C, sau đó với kháng thể thứ cấp liên hợp biotin tương ứng (Vector Laboratories) ở nhiệt độ phòng trong 1 giờ. Nhân được nhuộm đối màu với hematoxylin (KP&T, Cheong Ju, Hàn Quốc) và các tấm phủ được gắn bằng chất gắn DPX (Sigma-Aldrich).Các slide được quan sát bằng kính hiển vi quang học (Olympus, Tokyo, Nhật Bản) và được quét và chụp bằng máy quét slide (Motic, Vancouver, Canada). DAB được phân tích với ngưỡng màu nâu bằng phần mềm Image J (NIH). Năm vùng có cùng kích thước được chọn ngẫu nhiên và phân tích cho mỗi hình ảnh mô.
2.8. Xét nghiệm tăng sinh
Để phân tích tác động của PLLA lên tiềm năng tăng sinh của nguyên bào sợi, 5000 nguyên bào sợi được gieo vào mỗi giếng của đĩa nuôi cấy 96 giếng (SPL Life Sciences, Pocheon, Hàn Quốc) và mô hình trong ống nghiệm được tạo ra như mô tả trong Mục 2.2.2 và Mục 2.2.3 . Thuốc thử bộ đếm tế bào (CCK; TransGen Biotech Co., Ltd., Bắc Kinh, Trung Quốc) được pha loãng với môi trường không có huyết thanh (1:9, v / v ). Các tế bào được ủ với thuốc thử pha loãng trong 4 giờ ở 37 °C trong tủ ấm CO2 5% . Mật độ quang học được đo ở 450 nm bằng máy đọc đĩa (Multiskan SkyHigh Photometer; Thermo Fisher Scientific).
2.9. Miễn dịch huỳnh quang
Sau khi thu hồi kháng nguyên, các lát cắt mô da (lát cắt dày 5 μm) được chặn bằng huyết thanh bình thường (Vector Laboratories) ở nhiệt độ phòng trong 1 giờ, sau đó ủ với kháng thể chính (Bảng S1 ). Sau khi ủ, các lát cắt được rửa bằng PBS và ủ với kháng thể thứ cấp liên hợp huỳnh quang (Invitrogen) trong 1 giờ trong bóng tối. Nhân được nhuộm đối màu với DAPI (Sigma-Aldrich) ở nhiệt độ phòng trong 30 giây. Sau khi rửa bằng PBS, các tấm kính được gắn bằng môi trường gắn Vectashield (Vector Laboratories) và các phiến kính được phân tích qua kính hiển vi cộng hưởng (Carl Zeiss 710, Carl Zeiss) tại Cơ sở cốt lõi để chụp ảnh tế bào sang in vivo. Hình ảnh cộng hưởng được chụp ngẫu nhiên để phân tích hình ảnh và cường độ huỳnh quang được phân tích bằng phần mềm ZEN 2009 (Carl Zeiss).
2.10. Phân tích mô học
2.10.1. Nhuộm ba màu Masson
Sau khi khử parafin, các mô da (lát dày 5 μm) được ủ trong dung dịch Bouin (Phòng thí nghiệm Scytek, West Logan, UT, Hoa Kỳ) trong 1 giờ ở 60 °C, sau đó rửa sạch bằng nước cất. Sau đó, các lát cắt được nhuộm bằng dung dịch sắt hematoxylin Weigert (KP&T) trong 5 phút, dung dịch fuchsin axit biebrich scarlet (Phòng thí nghiệm Scytek) trong 5 phút, dung dịch axit phosphomolybdic-phosphotungstic (Phòng thí nghiệm Scytek) trong 12 phút và dung dịch xanh anilin (Phòng thí nghiệm Scytek) trong 3 phút. Các phiến nhuộm được gắn bằng chất gắn DPX và quan sát bằng kính hiển vi quang học (Olympus) được trang bị máy quét phiến (Motic). Các sợi collagen có màu xanh lam. Nhân có màu xanh lam đen và tế bào chất, keratin và sợi cơ có màu hồng và đỏ. Mật độ sợi collagen trong hình ảnh được phân tích bằng phần mềm Image J (NIH).
2.10.2. Nhuộm Herovici
Collagen trưởng thành và collagen mới được tạo ra đã được xác định trong các mô da bằng bộ dụng cụ nhuộm Herovici (Phòng thí nghiệm Scytek). Các phiến kính đã khử parafin được ủ trong 8 phút trong hematoxylin sắt Weigert để nhuộm nhân, sau đó rửa bằng nước máy, tiếp theo là nước cất. Các phiến kính được xử lý bằng dung dịch Herovici trong 2 phút, gắn bằng chất gắn DPX và quan sát bằng kính hiển vi Olympus được trang bị máy quét phiến kính (Motic). Các sợi nhuộm màu xanh lam trong tất cả các hình ảnh đại diện cho các sợi collagen mới tổng hợp và các sợi nhuộm màu đỏ ánh vàng đại diện cho collagen trưởng thành đã được định lượng trong tất cả các hình ảnh bằng phần mềm Image J (NIH).
2.10.3. Nhuộm Verhoeff
Các mô da đã khử parafin được xử lý bằng dung dịch nhuộm đàn hồi (Scytek Laboratories) trong 15 phút ở nhiệt độ phòng, sau đó rửa sạch bằng nước máy. Các phiến kính được ủ với 20 giọt dung dịch phân biệt sắt clorua 2% (Scytek Laboratories), rửa sạch bằng nước cất và gắn bằng chất gắn DPX. Các phiến kính được quan sát bằng kính hiển vi quang học được trang bị máy quét phiến kính (Motic). Mật độ sợi elastin màu xanh đen ở lớp hạ bì nhú được phân tích trong các hình ảnh chụp bằng phần mềm Image J (NIH).
2.11. Phân tích thống kê
Kiểm định Kruskal–Wallis, tiếp theo là kiểm định Mann–Whitney U post hoc, đã được thực hiện để so sánh các nhóm. Kết quả của nghiên cứu này đã được xác nhận bằng kiểm định t không ghép đôi sử dụng phần mềm SPSS phiên bản 22 (IBM Corporation, Armonk, NY, Hoa Kỳ). Tất cả các kết quả được trình bày dưới dạng giá trị trung bình ± độ lệch chuẩn và tất cả các thí nghiệm đều được lặp lại ba lần. Ý nghĩa thống kê được mô tả trong các chú thích hình ảnh tương ứng.
3. Kết quả
3.1. Hình thái và mô hình phân hủy của PLLA
Hình thái của các hạt PLLA được quan sát qua SEM mỗi tuần trong bốn tuần. Sự xuất hiện ban đầu của các hạt PLLA được quan sát ngay sau khi trộn chúng với PBS (Hình 1 A). Các hạt PLLA có hình tròn với bề mặt nhẵn. Số lượng các hạt PLLA giảm dần theo thời gian, trong khi hình thái bề mặt tròn của chúng vẫn được duy trì (Hình 1 A). Tốc độ phân hủy giảm từ 3 đến 4 tuần sau khi trộn (Hình 1 B).
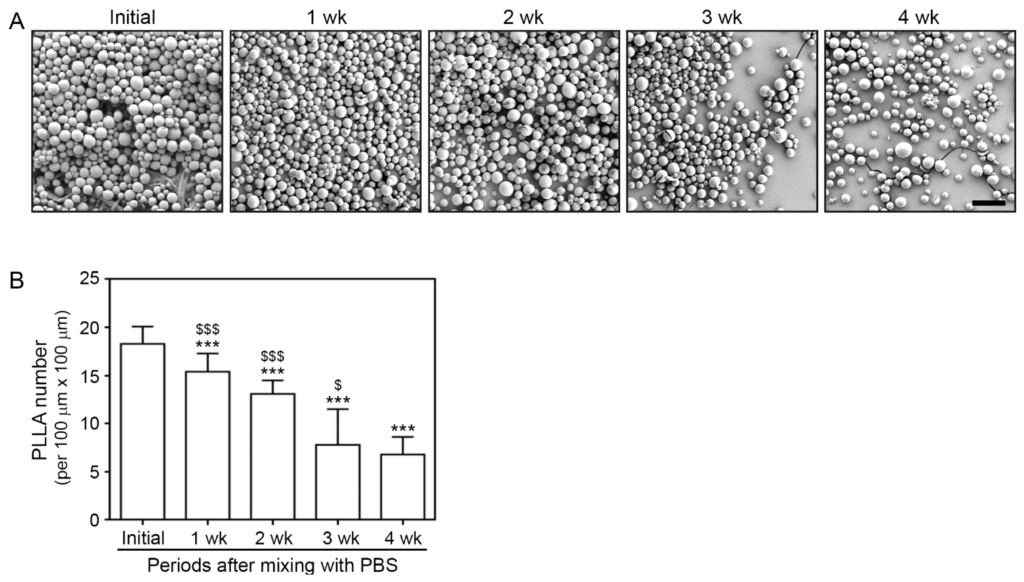
Hình 1. Số lượng PLLA giảm theo thời gian, trong khi hình dạng hình cầu của nó vẫn được duy trì. (A ) Hình thái PLLA đã được xác nhận thông qua SEM. Các hạt PLLA duy trì hình dạng tròn của chúng trong bốn tuần và giảm dần về số lượng (thanh tỷ lệ = 100 μm). (B ) Đồ thị định lượng số lượng PLLA trên diện tích 100 μm × 100 μm được đếm từ các diện tích được chọn ngẫu nhiên. Dữ liệu được trình bày dưới dạng trung bình ± SD. Một bảng chữ cái khác nhau chỉ ra sự khác biệt về ý nghĩa thống kê giữa các nhóm. ***, p < 0,001, thanh đầu tiên so với các thanh khác; $ và $ $ $ ,p < 0,05 và p < 0,001, thanh thứ năm so với thanh thứ hai, thứ ba và thứ tư. PLLA, axit poly-L-lactic; SD, độ lệch chuẩn; SEM, kính hiển vi điện tử quét; wk, tuần.
3.2. PLLA làm tăng biểu hiện IL-4 và IL-13 và phân cực M2 trong đại thực bào được xử lý bằng H 2 O 2 và da lão hóa
Lão hóa tế bào do H2O2 gây ra thường được sử dụng nhất trong các mô hình lão hóa trong ống nghiệm [36 ]. Do đó, chúng tôi đã sử dụng nó trong mô hình này để đánh giá tác động của PLLA lên các tế bào già. Sau khi gây lão hóa, chúng tôi xử lý các tế bào được gây ra và không được gây ra bằng PLLA hoặc PBS để so sánh phản ứng của các đại thực bào già và không già đối với PLLA (Hình S1 ).SA-β-gal, p21 và p16 là những dấu hiệu lão hóa tế bào nổi tiếng [37 ]. Mức độ hoạt động của SA-β-gal và biểu hiện p16 không khác biệt đáng kể ở các đại thực bào được xử lý bằng PBS sau khi dùng PLLA. Ngược lại, các đại thực bào được xử lý bằng H2O2 có mức độ hoạt động của SA-β-gal và biểu hiện p16 cao hơn so với các đại thực bào được xử lý bằng PBS, trong khi việc dùng PLLA làm giảm các đại thực bào được xử lý bằng H2O2. Các đại thực bào được xử lý bằng H2O2 có mức độ biểu hiện p21 tăng so với các đại thực bào được xử lý bằng PBS. PLLA làm giảm mức độ biểu hiện p21 ở cả các đại thực bào được xử lý bằng PBS và H2O2 (Hình S5 ).Sau đó, chúng tôi sử dụng mô hình lão hóa này để đánh giá liệu PLLA có làm tăng nồng độ IL-4 và IL-13 và gây ra phân cực M2 hay không. Nồng độ IL-4 và IL-13 được đánh giá trong CM từ các nuôi cấy đại thực bào thông qua ELISA. Xử lý H2O2 làm giảm nồng độ của các cytokine này; tuy nhiên, xử lý PLLA đã xóa bỏ hiệu ứng này. Hơn nữa, nồng độ IL-4 và IL-13 tăng lên trong các đại thực bào được xử lý bằng PBS sau khi xử lý bằng PLLA (Hình 2 A, B).
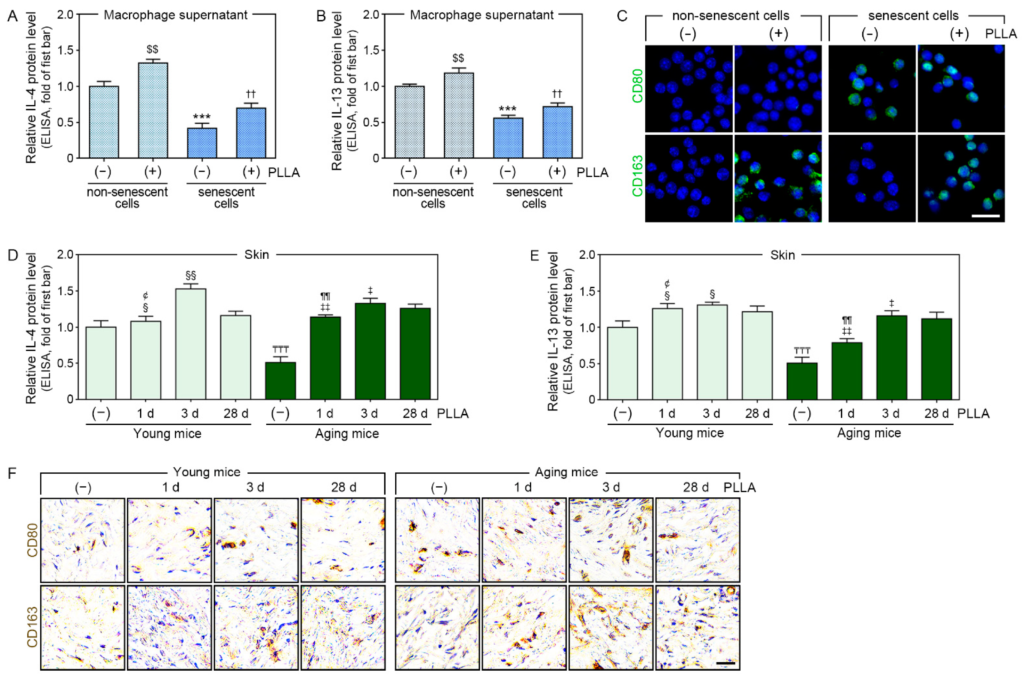
Hình 2. PLLA làm tăng tiết IL-4 và IL-13, dẫn đến phân cực M2. Các đại thực bào già hoặc không già do H2O2 gây ra được xử lý bằng PBS (thanh thứ nhất hoặc thứ ba) hoặc PLLA (thanh thứ hai hoặc thứ tư). ( A , B ) Mức độ IL-4 và IL-13 trong dịch nuôi cấy (CM) từ các đại thực bào già không già và do H2O2 gây ra được đo thông qua ELISA. (C ) Mức độ CD80 (dấu hiệu M1) và CD163 (dấu hiệu M2) trong các đại thực bào già và không già do H2O2 gây ra được phân tích bằng phương pháp miễn dịch tế bào học (màu xanh lá cây: tín hiệu dương tính, màu xanh lam: nhân; thanh tỷ lệ = 20 μm). Chuột trẻ hoặc già được tiêm nước muối hoặc PLLA và các mẫu da được thu thập sau 1 (thanh thứ 2 hoặc thứ 6), 3 (thanh thứ 3 hoặc thứ 7) và 28 ngày (thanh thứ 1, 4, 5 hoặc 8). (D ,E ) Mức độ IL-4 và IL-13 ở da trẻ và già được đo thông qua ELISA. (F ) Mức độ biểu hiện CD80 và CD163 ở da trẻ và già được phân tích thông qua nhuộm DAB (thanh tỷ lệ = 50 μm). Dữ liệu được trình bày dưới dạng trung bình ± SD (n = 3/nhóm).$ $ , p < 0,01, thanh đầu tiên so với thanh thứ hai trong (A ,B ); ***, p < 0,001, thanh đầu tiên so với thanh thứ ba trong (A , B ); ††, p < 0,01, thanh thứ ba so với thanh thứ tư trong ( A , B ); ₸₸₸ , p < 0,001, thanh đầu tiên so với thanh thứ năm trong ( D , E ); ¢,p < 0,05, thanh thứ ba so với thanh thứ hai trong ( D , E ); § và §§,p < 0,05 và p < 0,01, thanh thứ tư so với thanh thứ hai hoặc thứ ba trong (D , E ); ¶¶,p < 0,01, thanh thứ bảy so với thanh thứ sáu trong ( D ,E ); ‡ và ‡‡,p < 0,05 và p < 0,01, thanh thứ tám so với thanh thứ sáu hoặc thứ bảy trong (
D ,E ). CD80, cụm biệt hóa 80; CD163, cụm biệt hóa 163; CM, môi trường có điều kiện; d, ngày; DAB, 3,3′-diaminobenzidine; ELISA, xét nghiệm miễn dịch liên kết với enzyme; H2O2 , hydrogen peroxide; IL-4, interleukin-4; IL-13, interleukin-13; PBS, dung dịch đệm phosphat; PLLA, axit poly-L-lactic; SD, độ lệch chuẩn.

