1.Skin booter: Giới thiệu
Cụm từ “chất tăng cường da” đã trở nên nổi bật trong ngành thẩm mỹ, biểu thị việc sử dụng các sản phẩm làm đầy axit hyaluronic (HA) có liên kết chéo thấp để đưa HA vào lớp hạ bì của da, nhằm mục đích cải thiện tình trạng lão hóa da và làm mờ nếp nhăn. Trong khi chất làm đầy HA ban đầu được sử dụng chủ yếu để tăng thể tích, việc sử dụng các chất làm đầy này để tăng cường da đã xuất hiện để cải thiện tình trạng da bằng cách củng cố ma trận ngoại bào (ECM) ở lớp hạ bì. Mặc dù có các nhãn hiệu như Restylane Skinboosters “Vital” và “Vital Light”, thuật ngữ “chất tăng cường da” đã phát triển thành một thuật ngữ chung được sử dụng rộng rãi, tương tự như cách “Botox” được sử dụng rộng rãi để chỉ các sản phẩm độc tố botulinum (BoNT) trong các quy trình do Allergan thực hiện.
Các chất tăng cường da góp phần đáng kể vào việc làm chậm và cải thiện quá trình lão hóa da. Quá trình lão hóa da liên quan đến sự suy giảm số lượng tế bào biểu bì và hạ bì, sự suy giảm của các đường viền lưới, mức độ collagen và elastin giảm và sự suy giảm glycosaminoglycan. Ngoài ra, mức độ cao của các loài oxy phản ứng góp phần vào sự phân hủy các chất chống oxy hóa trong các mô, dẫn đến giảm tác dụng chống oxy hóa, kích hoạt các tế bào hắc tố dẫn đến da sẫm màu và tăng sự bất thường về sắc tố. Các chất tăng cường da can thiệp vào các quá trình này bằng cách tăng cường và củng cố môi trường ngoại bào, cải thiện các vấn đề về sắc tố, tình trạng viêm và giãn mạch để biểu hiện các tác dụng có lợi của chúng.
Mặc dù ngày càng có nhiều loại và mục tiêu của chất tăng cường da trong lĩnh vực thực hành thẩm mỹ, nhưng vẫn chưa có định nghĩa cụ thể, toàn diện cho thuật ngữ này. Tuy nhiên, việc xem xét định nghĩa chất tăng cường da là bao gồm nhiều thành phần được sử dụng để tăng cường và cải thiện tình trạng da là hợp lý.
2. Skin booter: Phân loại
2.1. Axit hyaluronic
Chất làm đầy có nhiều đặc điểm khác nhau, bao gồm các biến thể về kích thước hạt chất làm đầy, giảm liên kết chéo và tăng cường sự thoải mái khi tiêm, đã được nhiều công ty phát triển và sử dụng rộng rãi trong các ứng dụng thương mại. HA có sẵn trong lớp hạ bì của da, nổi tiếng với khả năng giữ ẩm, hỗ trợ hydrat hóa và kích thích tiết ra các yếu tố tăng trưởng (GF) trong các mô liên kết của da. 1Thử nghiệm lâm sàng ngẫu nhiên của Gao et al., 2 liên quan đến 129 phụ nữ ở nhiều độ tuổi và loại da khác nhau đã kiểm tra tác động của HA uống vào sức khỏe làn da. Nghiên cứu cho thấy sự cải thiện đáng kể về độ ẩm của da trong vòng 2–8 tuần đối với cả người tham gia trẻ và lớn tuổi, tiếp theo là tông màu da được cải thiện sau 4–8 tuần và độ dày biểu bì tăng lên sau 12 tuần bổ sung HA. Nhìn chung, các phát hiện ủng hộ mạnh mẽ hiệu quả của việc bổ sung HA uống vào trong việc thúc đẩy sức khỏe làn da ở nhiều nhóm tuổi và loại da khác nhau.
Trong bối cảnh chất tăng cường da HA, có thể phân biệt hai loại: HA không liên kết chéo và HA liên kết chéo thấp. Chất tăng cường da HA có nhiều mục đích khác nhau như cung cấp độ ẩm cho lớp hạ bì, phát huy tác dụng chống oxy hóa, mở rộng thể tích ở lớp hạ bì và lớp dưới da, và tăng cường sản xuất collagen ở lớp hạ bì. HA, với khả năng liên kết với tới 218 phân tử nước của mỗi phân tử, ngăn ngừa khô da và tăng thể tích ở lớp hạ bì và lớp dưới da. Năm 2007, Wang và cộng sự đã quan sát thấy sự mở rộng nguyên bào sợi và sự hình thành collagen mới dưới kính hiển vi điện tử thông qua sinh thiết da được thực hiện ở tuần thứ 4 và tuần thứ 13 sau khi tiêm chất làm đầy HA liên kết chéo vào cẳng tay của 11 người cao tuổi. 3 HA được tiêm vào lớp hạ bì hấp thụ độ ẩm từ ECM, mở rộng thể tích tổng thể lên 500–1000 lần kích thước phân tử của nó, dẫn đến sự kéo dài nguyên bào sợi và sự hình thành collagen mới. Các nguyên bào sợi kéo dài khởi đầu quá trình biểu hiện GF mô liên kết, GF-beta1 chuyển dạng và GF-beta2 chuyển dạng cần thiết cho quá trình hình thành collagen mới, đồng thời cũng biểu hiện các gen ức chế metalloproteinase mô (gen ức chế metalloproteinase-1, gen ức chế metalloproteinase-2, gen ức chế metalloproteinase-3), do đó ức chế quá trình phân hủy collagen.
Là chất tăng cường da, chất làm đầy HA không liên kết chéo có tác dụng làm đầy thể tích ít hơn và thời gian tác dụng ngắn hơn so với HA liên kết chéo. Tuy nhiên, chúng khuếch tán tốt vào các mô ngoại vi, gây ra ít bất thường hơn trên bề mặt da sau thủ thuật. Do đó, chúng phù hợp để dưỡng ẩm cho các vùng da mỏng và khô như vùng mắt. Ngược lại, HA liên kết chéo, do tác dụng làm đầy thể tích và thời gian tác dụng kéo dài, hữu ích hơn ở các vùng khác ngoài vùng mắt.
Các sản phẩm làm đầy HA, được phân loại là chất tăng cường da, đang chuẩn bị củng cố sự hiện diện trên thị trường thông qua những tiến bộ liên tục. Tuy nhiên, quy trình này vẫn tồn tại những hạn chế cố hữu. Trước hết, thời gian tác dụng của nó thay đổi theo tài liệu nhưng thường kéo dài khoảng sáu tháng sau ba lần điều trị. Thứ hai, sự khó chịu trong quá trình tiêm vẫn là một mối quan tâm. Cuối cùng, việc đạt được sự phân phối chính xác chất làm đầy HA đến vị trí và lớp da mong muốn đặt ra một thách thức. Đã có những câu hỏi thường xuyên về độ chính xác của việc phân phối chất làm đầy HA đến lớp hạ bì. Tuy nhiên, với các phương pháp phân phối HA vào lớp hạ bì ngày càng phát triển và chính xác hơn, người ta dự đoán sẽ có những kết quả cải thiện trong tương lai. 4Nghiên cứu của Chen và cộng sự. 5 đã khám phá hiệu quả của một phức hợp hyaluronan mới chống lại quá trình lão hóa da nội tại, tiết lộ nhiều cơ chế của nó. Sử dụng phân tích miễn dịch mô học và xét nghiệm, nghiên cứu đã chứng minh khả năng của phức hợp này trong việc tăng biểu hiện collagen loại I trong khi ức chế sản xuất metalloproteinase-1 ma trận trong nguyên bào sợi của con người. Phức hợp này cũng cho thấy lợi ích trong các chất tương đương da bằng cách tăng cường biểu hiện protein liên kết biểu bì-thượng bì. Nghiên cứu chứng minh khái niệm này cho thấy phức hợp hyaluronan sở hữu tác dụng chống lão hóa bằng cách ảnh hưởng đến biểu hiện metalloproteinase-1 ma trận, thúc đẩy sự tích tụ collagen và tăng cường biểu hiện protein liên kết biểu bì-thượng bì, mở ra những hướng đi mới cho nghiên cứu hyaluronan.
Trong các nghiên cứu gần đây, sự kết hợp của HA với glycerol (Belotero Revive, Merz Pharmaceuticals GmbH, Frankfurt, Đức) (Hình 1 ) đã chứng minh sự cải thiện đáng kể và bền vững về độ ẩm, độ đàn hồi, độ săn chắc và độ sáng của da trong tối đa 36 tuần. 6 , 7 Đáng chú ý, glycerol được đưa vào như một chất phụ gia bổ sung trong các công thức này. Được Schwarz và cộng sự nhấn mạnh, 8 chất dưỡng ẩm đóng vai trò quan trọng trong việc duy trì tính toàn vẹn của hàng rào bảo vệ da và điều chỉnh độ ẩm, bao gồm chất làm tắc nghẽn, chất làm ẩm và chất làm mềm. Glycerol, hoạt động như một chất làm ẩm, nổi bật với khả năng liên kết nước đáng chú ý, tăng cường độ ẩm cho da và tăng cường khả năng phục hồi và chức năng bảo vệ của tế bào sừng trưởng thành. 9

Belotero Revive, một loại gel axit hyaluronic tiêm được sản xuất bởi Merz Pharmaceuticals GmbH, Frankfurt, Đức, được sử dụng trong da liễu thẩm mỹ để cải thiện chất lượng da. Glycerol được kết hợp như một thành phần bổ sung.
2.2. Axit poly-L-lactic và axit poly-D-lactic
Để duy trì độ đàn hồi và chống lão hóa, nhiều quy trình trước đây đã kích thích lớp hạ bì thông qua việc chọc thủng da hoặc các thiết bị dựa trên năng lượng. Tuy nhiên, những phương pháp mới được giới thiệu gần đây bao gồm các phương pháp kích thích lớp hạ bì không phải bằng nhiệt hoặc kim mà thông qua việc sử dụng các thành phần tăng cường da.
Các polyme hiện được sử dụng như chất tăng cường da. Trong khi chất làm đầy HA được đánh giá cao vì tính tự nhiên và đặc tính tăng cường da, thì hạn chế của chúng nằm ở khả năng duy trì thể tích trong thời gian ngắn khi giải quyết các vấn đề như sẹo. Do đó, nhu cầu về chất làm đầy tăng cường da trong các cơ sở lâm sàng ưu tiên duy trì thể tích lâu dài và đảm bảo an toàn. Sculptra, sử dụng axit poly-L-lactic (PLLA) làm vật liệu thay thế, đã được sử dụng để đáp ứng nhu cầu này. 10 Sculptra ban đầu có hiệu quả trong việc kích thích tổng hợp collagen rộng rãi, đặc biệt ở những bệnh nhân bị mất thể tích khuôn mặt nhanh chóng như những người bị hội chứng suy giảm miễn dịch mắc phải. Tuy nhiên, vẫn có những lo ngại liên tục liên quan đến sự bất thường của các hạt, sự thay đổi kích thước, không đồng đều, lồi lõm và sự hình thành các u hạt. Để ứng phó với những thách thức này, PLLA, một đồng phân của axit poly-lactic, đã được phát triển. Các sản phẩm như BLLV® (Sihler Inc., Hàn Quốc) đã cải thiện tính đồng nhất về kích thước hạt và giảm kích thước trong khi kết hợp HA thay vì carboxymethylcellulose (Hình 2 ). Bất chấp sự cải thiện này, việc sử dụng các sản phẩm gốc polyme trong lớp hạ bì vẫn tiếp tục gây ra sự không chắc chắn cho các bác sĩ, đòi hỏi phải theo dõi lâu dài các phản ứng miễn dịch tiềm ẩn liên quan đến các tế bào khổng lồ quy mô lớn. 11 , 12 Điều này gợi nhớ đến kinh nghiệm gặp phải với các khối u hạt trong quá khứ khi sử dụng PLLA. Ngoài ra, có những chất tăng cường da kích thích mô bằng cách tiêm dung dịch nồng độ cao, liên quan đến việc sử dụng dung dịch dextrose ưu trương. Vật liệu này thường được sử dụng trong liệu pháp tăng sinh để kiểm soát cơn đau và liệu pháp phục hồi chức năng. Theo Regina và cộng sự vào năm 2016, dung dịch dextrose ưu trương tan trong nước và được coi là chất tăng sinh lý tưởng do tính an toàn của nó ngay cả khi được tiêm với số lượng lớn vào nhiều vùng của các thành phần dịch trong cơ thể. 13 Cho đến nay, việc sử dụng dextrose ưu trương trong mỹ phẩm chỉ giới hạn ở một số hoạt động da liễu nhất định và bằng chứng hỗ trợ cho việc sử dụng thẩm mỹ của nó vẫn còn khan hiếm.

Poly-L-lactic acid (PLLA), một đồng phân của poly-lactic acid, đã được phát triển. BLLV (Sihler Inc., Hàn Quốc) (A) chứng minh tính nhất quán về kích thước hạt được cải thiện và kích thước giảm bằng cách sử dụng axit hyaluronic thay vì carboxymethylcellulose, như quan sát được qua kính hiển vi điện tử quét (B).
2.3. Deoxyribonucleic (polydeoxyribonucleotide và polynucleotide)
Polynucleotide (PN) ngày càng trở nên phổ biến trong các ứng dụng thẩm mỹ và mỹ phẩm toàn cầu do khả năng tương thích sinh học đặc biệt của chúng. Có nguồn gốc từ tuyến sinh dục cá hồi chum hoặc cá hồi vân, PN nổi bật so với các chất kích thích sinh học khác vì nó có nguồn gốc từ nguồn gốc tự nhiên thay vì là các sản phẩm dựa trên polyme tổng hợp. Điều đáng kể là PN và polydeoxyribonucleotide (PDRN) khác nhau ở một số khía cạnh: PN có nguồn gốc từ tinh hoàn, trong khi PDRN có nguồn gốc từ tế bào tinh trùng. Đáng chú ý, PN có chuỗi nucleotide dài hơn và trọng lượng phân tử cao hơn, như bằng chứng trong nghiên cứu gần đây. Hơn nữa, PN thể hiện cấu trúc khung riêng biệt, giúp nó khác biệt với các công thức PDRN. Vào năm 2014, PN đầu tiên được sử dụng làm chất tăng cường da là Rejuran® (Hình 3 ).
Năm 1989, Bruroni và cộng sự đã triển khai PDRN ở những bệnh nhân bị lộ tuyến cổ tử cung, 14 tiếp theo là việc Perino và cộng sự sử dụng PDRN để tái tạo biểu mô sau khi đốt điện vào năm 1990. 15 Hơn nữa, Muratore và cộng sự đã tiến hành nghiên cứu vào năm 1997 liên quan đến PDRN nhau thai người trên nguyên bào sợi da đầu gối người được nuôi cấy ban đầu. Sau đó, vào năm 1999, Thellung và cộng sự đã công bố một bài báo quan trọng làm sáng tỏ vai trò của thụ thể A2A trong cơ chế hoạt động của PDRN. 17 Các nghiên cứu bổ sung đã đi sâu vào ứng dụng của PDRN trong nhiều lĩnh vực khác nhau như chữa lành vị trí ghép da, 18 , 19 kích thích nguyên bào sợi giác mạc trong nuôi cấy, thúc đẩy sự tăng sinh tế bào tạo xương ở người, 20 , 21 và tạo điều kiện cho quá trình hình thành mạch máu. 22 , 23
Một khám phá đáng chú ý là khả năng của PDRN trong việc tăng cường sửa chữa dimer cyclobutene pyrimidine trong nguyên bào sợi da tiếp xúc với tia cực tím B. 24 Nghiên cứu gần đây cũng đã phát hiện ra nhiều đặc tính khác nhau của PDRN, bao gồm vai trò của nó trong quá trình chống hình thành timelan, 25 , 26 tác dụng chống dị ứng, 27 sinh tổng hợp ty thể, 25 và ứng dụng tiềm năng của nó trong việc gây ra quá trình nâu hóa mỡ nhằm mục đích chống béo phì. 28 Ngược lại, PN bao gồm các chuỗi nucleotide dài hơn và có ít nghiên cứu hỗ trợ tác dụng của chúng hơn. Năm 2016, Park và cộng sự đã chứng minh rằng PN cải thiện nhiều thông số về da như kích thước lỗ chân lông, độ dày của da, tông màu, mức độ melanin, nếp nhăn và tình trạng chảy xệ trong một nghiên cứu có sự tham gia của năm bệnh nhân. 29 Tương tự như vậy, trong một thử nghiệm ngẫu nhiên, mù đôi, có đối chứng của Kim và cộng sự vào năm 2018, 44 bệnh nhân đã phẫu thuật cắt tuyến giáp đã cho thấy sự cải thiện đáng kể về sẹo sau phẫu thuật khi được điều trị bằng PN. Sự cải thiện này được chứng minh bằng điểm số thang điểm sẹo Vancouver được cải thiện đáng kể, phân tích chiều cao ba chiều, sự hài lòng của bệnh nhân được cải thiện và chỉ số ban đỏ giảm. 30
Năm 2022, Lee và cộng sự đã tiến hành một thử nghiệm ngẫu nhiên, mù đôi, chia đôi khuôn mặt với 27 đối tượng được tiêm chất làm đầy PN và HA không liên kết chéo. Nghiên cứu cho thấy nhóm PN cho thấy tỷ lệ cải thiện lớn hơn về thể tích lỗ chân lông và độ nhám so với nhóm còn lại. Tuy nhiên, sự cải thiện được quan sát thấy không đạt đến ý nghĩa thống kê liên quan đến thang đo cải thiện thẩm mỹ toàn cầu, thang đo tương tự thị giác hoặc mật độ da. 31 Trong những diễn biến gần đây, Kim và cộng sự đã công bố hai trường hợp chứng minh việc sử dụng thành công PN để làm đầy các vùng trên khuôn mặt thường được điều trị bằng các loại chất làm đầy da khác. 32 Lee và cộng sự đã tiến hành một cuộc khảo sát với sự tham gia của 557 bác sĩ người Hàn Quốc, cho thấy phần lớn các bác sĩ sử dụng PN để giải quyết các vấn đề ban đỏ khác nhau trên khuôn mặt. Hơn 80% các bác sĩ được khảo sát coi phương pháp điều trị PN là “hiệu quả” hoặc “rất hiệu quả”. 33 Quan trọng là, trong các nghiên cứu đã đề cập ở trên, có hai điểm chính nổi bật: Thứ nhất, không có trường hợp nào được ghi nhận về các tác dụng phụ nghiêm trọng, điều này nhấn mạnh tính an toàn của phương pháp điều trị. Thứ hai, mặc dù cơ chế hoạt động vẫn chưa chắc chắn, nhưng người ta cho rằng do sự tương đồng về mặt phân tử giữa PN và PDRN, PN có thể hoạt động thông qua một cơ chế tương tự như cơ chế của PDRN. Tuy nhiên, cho đến nay, giả định này vẫn thiếu cơ sở khoa học.

Rejuran (Pharmaresearch Inc., Hàn Quốc) là một trong những sản phẩm polynucleotide được sử dụng để trẻ hóa da, cung cấp nhiều độ nhớt và thành phần khác nhau, bao gồm lidocaine và axit hyaluronic.
2.4. Huyết tương giàu tiểu cầu
Huyết tương giàu tiểu cầu (PRP) là huyết tương có tiểu cầu cô đặc cao lấy từ máu tự thân. Tiểu cầu trong PRP chứa một số thành phần như yếu tố đông máu, GF, chemokine và cytokine. 34 Các thành phần này kích thích tăng trưởng tế bào và cân bằng da, cho phép PRP có lợi cho quá trình tái tạo sinh học. PRP, mới được phân lập từ máu, tồn tại ở trạng thái không đông trước khi kích hoạt tiểu cầu để giải phóng GF có trong chúng, cho phép chúng được sử dụng có lợi.
Tiểu cầu, có nguồn gốc từ megakaryocyte, không có nhân, có đường kính 2–3 μm và độ dày khoảng 1,5 μm, và có tuổi thọ khoảng 8–10 ngày. Một phần ba tiểu cầu của cơ thể được lưu trữ trong lá lách, trong khi hai phần ba còn lại lưu thông trong máu ngoại vi. PRP đã trở nên phổ biến như một chất tăng cường da nổi bật trong các ứng dụng mỹ phẩm do hiệu quả đã được chứng minh trong nhiều nghiên cứu, chủ yếu là do nhiều hoạt chất sinh lý có trong các hạt lưu trữ tiểu cầu.
Các hạt lưu trữ tiểu cầu bao gồm ba loại: hạt alpha, hạt lysosome và hạt đặc, trong đó hạt alpha chứa nhiều GF. 35
Các hạt alpha chứa các GF như GF có nguồn gốc từ tiểu cầu, GF-beta chuyển dạng (TGF-β), GF nội mô mạch máu, GF biểu mô, cùng với yếu tố von Willebrand, fibronectin, fibrinogen, vitronectin, các yếu tố đông máu (yếu tố đông máu V, protein S), các chất chống xơ hóa, chemokine và các chất khác.
Các hạt lysosome lưu trữ nhiều loại enzyme tiêu hóa. Các hạt đặc chứa các chất như serotonin, adenosine diphosphate), adenosine triphosphate và một số glycoprotein có trên màng tiểu cầu đóng vai trò quan trọng trong quá trình cầm máu ban đầu.
PRP bao gồm 94% tiểu cầu, 5% hồng cầu và 1% bạch cầu. Để đạt được hiệu quả lâm sàng, cần có ngưỡng tiểu cầu cụ thể trong PRP. Thông thường, nên có ít nhất một triệu tiểu cầu trên một microlit hoặc gấp 4–7 lần số lượng tiểu cầu bình thường.
Nguyên tắc cốt lõi của liệu pháp PRP liên quan đến việc kích hoạt nhiều cytokine hoặc GF trong tiểu cầu bằng cách thêm thrombin tự thân hoặc canxi ion hóa trong quá trình kích hoạt PRP cô đặc tốt. Các cytokine này kích thích quá trình chữa lành vết thương và tái tạo mô.
Sản xuất PRP bao gồm phương pháp quay đơn và phương pháp quay đôi dựa trên ly tâm. Gần đây, phương pháp quay đơn đã trở nên phổ biến do có nhiều bộ dụng cụ PRP thân thiện với người dùng và một trong số đó là NRP20, bộ dụng cụ PRP được công nhận rộng rãi được sử dụng ở Hàn Quốc, được trang bị ống ly tâm (N-Finders, Hàn Quốc) để tạo điều kiện tách các thành phần này (Hình 4 ).
Lão hóa da mặt cho thấy số lượng nguyên bào sợi giảm đi với sản xuất collagen và các protein ECM khác giảm, dẫn đến nếp nhăn, da chảy xệ, thô ráp và sắc tố. 36 PRP có thể gây ra sự tái tạo ECM và kích thích sự tăng sinh nguyên bào sợi của da và tổng hợp collagen, do đó sửa chữa các dấu hiệu chung của lão hóa da. Khi PRP được tiêm vào lớp hạ bì, nó gây ra phản ứng viêm nhẹ của da, kích thích quá trình chữa lành. Kết quả là, quá trình tổng hợp collagen được kích hoạt và da có thể trở nên săn chắc và khỏe mạnh hơn. 37 Tình trạng da được cải thiện đáng kể trong vòng 3 tuần. Để tái tạo collagen hoàn toàn cần khoảng 3 tháng. 38 , 39 Trong một nghiên cứu, ba buổi tiêm PRP nội bì đã được thực hiện trên 12 bệnh nhân nữ. Các mũi tiêm được áp dụng trên trán, vùng chân chim, má và nếp gấp mũi má. 40 Những cải thiện đã được đánh giá bằng bảng câu hỏi về sự hài lòng của bệnh nhân, hình ảnh và các nhà nghiên cứu. Không có tác dụng phụ nghiêm trọng nào được quan sát thấy. Theo bảng câu hỏi về hình ảnh và sự hài lòng, kết quả cho thấy kết cấu da, độ đàn hồi, chức năng hàng rào và nếp nhăn được cải thiện.
40 Trong một nghiên cứu gần đây về khuôn mặt chia đôi, hiệu quả của tiêm PRP dưới da đối với da mặt lão hóa. Tiêm nước muối dưới da là nhóm đối chứng. Điểm lão hóa do ánh sáng trung bình của 19 người tham gia được đánh giá bởi hai bác sĩ da liễu. Kết cấu da, nếp nhăn, sắc tố và giãn mạch được cải thiện ở bên được tiêm PRP. Tuy nhiên, các nếp nhăn nhỏ, sắc tố loang lổ, độ nhám và tình trạng vàng vọt không có sự khác biệt đáng kể.
41 Để đánh giá hiệu quả của liệu pháp PRP đối với việc trẻ hóa, Abuaf và cộng sự
đã tiến hành sinh thiết bằng kim trên da người. Các mẫu được lấy từ vùng dưới tai trong ba mốc thời gian khác nhau, trước khi tiêm, 28 ngày sau khi tiêm PRP và 28 ngày sau khi tiêm nước muối. Nhóm tiêm PRP cho thấy sợi collagen và sợi đàn hồi tăng lên so với nhóm đối chứng và nhóm tiêm nước muối. Những tác dụng này cho phép liệu pháp PRP giúp cải thiện nếp nhăn, sẹo phì đại, tông màu da và các tình trạng viêm khác. Tuy nhiên, hiệu quả của chất tăng cường da PRP không phụ thuộc vào sự khác biệt về liều lượng.
43 PRP năm phần trăm cho thấy tổng hợp collagen được kích thích nhiều hơn so với PRP 10%. Ngoài ra, số lượng tăng sinh nguyên bào sợi lớn hơn được quan sát thấy ở PRP 5% so với PRP 10%. PRP như chất tăng cường da thường được thực hiện bằng phương pháp vi kim hoặc tiêm vi điểm và không cho thấy sự khác biệt đáng kể nào về cải thiện giữa các kỹ thuật này.
44Theo nhiều nghiên cứu, PRP có nguy cơ tác dụng phụ tương đối thấp so với các phương pháp trẻ hóa da khác vì đây là sản phẩm có nguồn gốc tự thân. Các tác dụng phụ có thể xảy ra là đau, nhiễm trùng, đỏ, sưng và bầm tím. Mặc dù quy trình sản xuất PRP đơn giản và nhanh chóng, do đó ngày càng trở nên phổ biến như một liệu pháp trẻ hóa da, nhưng hiệu quả và tính an toàn của liệu pháp PRP vẫn còn gây tranh cãi.

Bộ dụng cụ PRP thân thiện với người dùng, chẳng hạn như NRP20 (A), một bộ dụng cụ PRP được công nhận rộng rãi tại Hàn Quốc. Nó được trang bị ống ly tâm (N-Finders, Hàn Quốc) để tạo điều kiện tách các thành phần (B).
2.5. Các yếu tố tăng trưởng
Trong suốt lịch sử, GF đã trở thành một trong những phiên bản đầu tiên của chất tăng cường da. Nổi tiếng với khả năng kích thích các tế bào khác nhau và hỗ trợ chữa lành vết thương, các yếu tố này đã được đưa vào da bằng các kỹ thuật như PRP. Hơn nữa, có một xu hướng ngày càng tăng là kết hợp GF vào các sản phẩm mỹ phẩm như một thành phần được biết đến với đặc tính tăng cường da. 45
Ngoài ra, hầu như tất cả các sản phẩm đều được bào chế với các thành phần bao gồm GF hoặc tạo điều kiện cho quá trình tạo ra GF. 46 Tuy nhiên, phần lớn các thụ thể tế bào tiếp nhận GF đến từ các tế bào bị tổn thương chứ không phải tế bào bình thường. 47 Điều cần thiết là phải cân nhắc đến những lợi ích tiềm tàng của việc cung cấp GF cho làn da khỏe mạnh. Các tác giả đưa ra giả thuyết rằng liệu pháp GF có thể thể hiện hiệu quả cao hơn trong việc kích hoạt quá trình chữa lành vết thương khi đi kèm với các kích thích như thiết bị dựa trên năng lượng hoặc kim châm. Ngoài ra, cần có một khoảng thời gian nhất định để các thụ thể GF khác nhau được thiết lập đầy đủ khi bắt đầu quá trình chữa lành vết thương.
Kể từ khi Cohenn làm sáng tỏ vai trò của GF biểu bì (EGF) trong quá trình phân chia tế bào vào năm 1986, GF đã được công nhận là thành phần cơ bản trong quá trình tái tạo tế bào. Nhiều phát hiện nghiên cứu khác nhau đã xác nhận nhu cầu về các GF khác nhau ở các giai đoạn khác nhau của quá trình chữa lành tổn thương mô. Chúng được xác định là những yếu tố trực tiếp và hiệu quả nhất tác động lên tổn thương. Ngoài ra, nhiều loại vitamin có liên quan đến quá trình lão hóa da. Ví dụ, vitamin C đẩy nhanh quá trình tổng hợp DNA và hoạt động như một chất chống oxy hóa thiết yếu cho quá trình tổng hợp collagen. Vitamin A đóng vai trò quan trọng trong việc điều chỉnh quá trình tái tạo biểu bì và hoạt động của tế bào melanin, thể hiện tác dụng chống oxy hóa, kết hợp với Vitamin C, hỗ trợ quá trình tổng hợp collagen và các thành phần ECM khác. Vitamin E góp phần điều chỉnh quá trình tái tạo sinh lý của da và tạo điều kiện phục hồi da bị tổn thương. Vitamin B rất cần thiết cho nhiều chức năng của tế bào, đóng vai trò là chất xúc tác trong quá trình tạo ra, phân hủy và truyền năng lượng từ carbohydrate, chất béo, protein và quá trình tổng hợp nhiều phân tử sinh học khác nhau.
Trong số các khoáng chất, canxi chủ yếu điều chỉnh cân bằng nội môi tế bào, trong khi phốt pho rất quan trọng đối với sự hình thành thành tế bào và các màng sinh học khác. Hơn nữa, magiê rất cần thiết để duy trì nhiều phản ứng enzyme bình thường và đóng vai trò quan trọng trong chức năng bình thường của tế bào. Axit amin thúc đẩy sự tăng sinh nguyên bào sợi, kích thích tổng hợp collagen, tạo ra GF và làm giảm tốc độ phân hủy collagen.
Thông thường, dựa trên các tài liệu có sẵn, ngoài PDGF, cần khoảng 12–24 giờ để các thụ thể phát triển hoàn chỉnh. 48 Do đó, điều quan trọng là phải đánh giá tính hữu ích của việc sử dụng GF trong trường hợp tính an toàn của thụ thể có thể bị tổn hại. 49 Phần lớn GF đều mang điện tích dương, gây ra thách thức đáng kể trong giai đoạn thâm nhập vào da. Tuy nhiên, khi đến lớp hạ bì, nơi các tế bào mang điện tích âm, các yếu tố này có xu hướng bị thu hút về phía chúng. Đáng chú ý là lớp biểu bì trong vết thương cũng mang điện tích âm, tạo điều kiện cho GF thâm nhập. Chỉ dựa vào khả năng hấp thụ GF tự nhiên của da mà không sử dụng nhiều phương pháp tăng cường hấp thụ khác nhau có thể không mang lại kết quả tối ưu. Gần đây, nhiều GF khác nhau đã được ứng dụng trong liệu pháp sắc tố da. Ví dụ, GF nội mô được công nhận có khả năng ức chế quá trình hình thành melanogenesis và giảm hoạt động của tyrosinase, khiến nó trở thành một lựa chọn khả thi để giải quyết các vấn đề về sắc tố sau laser. Hơn nữa, việc hiểu và phân biệt được việc sử dụng các GF khác nhau là rất quan trọng để đạt được kết quả mong muốn. Một ví dụ về chất tăng cường da sử dụng nhiều yếu tố tăng trưởng được nuôi cấy bởi nguyên bào sợi (QTcell, S.THEPHARM Co., Ltd., Seoul, Hàn Quốc). Chất tăng cường da kết hợp một kỹ thuật nuôi cấy đặc biệt được gọi là “Hình cầu tế bào được tăng cường chức năng” vào quá trình nuôi cấy nguyên bào sợi da người. Trong quá trình này, các tế bào bám dính lỏng lẻo vào ma trận protein tái tổ hợp, đồng thời gây ra sự liên kết tế bào với tế bào. 50 Với thời gian nuôi cấy kéo dài, tương tác giữa các tế bào vượt trội hơn so với tương tác giữa các tế bào và ma trận, dẫn đến sự hình thành các hình cầu đồng nhất (Hình 5 ). Kỹ thuật này làm tăng đáng kể nồng độ các yếu tố tăng trưởng như FGF, HGF và PDGFRa.
Chất tăng cường da dựa trên yếu tố tăng trưởng được sản xuất bởi nguyên bào sợi (QTcell của S.THEPHARM Co., Ltd. tại Seoul, Hàn Quốc) (A). Chất tăng cường da này áp dụng phương pháp nuôi cấy độc đáo có tên là “Functionally Enhanced Cell Spheroid” để nuôi cấy nguyên bào sợi da người (B). Trong quá trình này, các tế bào bám lỏng lẻo vào ma trận protein, thúc đẩy các kết nối tế bào với tế bào đồng thời.
2.6. Ngoại bào
Trong những năm gần đây, lĩnh vực da liễu và thẩm mỹ đã chứng kiến sự gia tăng đáng kể trong ứng dụng của secretome và exosome. Những tiến bộ này được thúc đẩy bởi sự hiểu biết sâu sắc hơn về giao tiếp tế bào và y học tái tạo. Chúng đang được khai thác để cung cấp các GF, protein và vật liệu di truyền cụ thể trực tiếp đến các tế bào mục tiêu, tăng cường sửa chữa và tái tạo mô. Chất tăng cường da là một loạt các thành phần cải thiện ma trận ngoại bào của lớp hạ bì để cải thiện tình trạng của da. Exosome là một trong một loạt các sản phẩm tăng cường da đã được thảo luận rộng rãi trong những năm gần đây. Mặc dù vẫn cần phải khám phá thêm và nghiên cứu chuyên sâu về nguồn vật liệu, hiệu quả, độ an toàn và các lợi ích bổ sung tiềm năng, một số nghiên cứu đã đưa ra những lời giải thích và kết quả đủ tốt và đầy hứa hẹn. Sau đây là một lời giải thích ngắn gọn về cơ chế ứng dụng exosome trong việc cải thiện chất lượng ở từng lớp da. Exosome, loại túi ngoại bào nhỏ nhất, có kích thước trong khoảng 30–110 nm, bao bọc protein, mRNA, miRNA và lipid trong lớp kép lipid có nguồn gốc từ màng tế bào, góp phần đáng kể vào các giai đoạn chữa lành vết thương và trẻ hóa da. Mặc dù exosome có nhiều trong tự nhiên, nhưng lại đặt ra thách thức đáng kể trong việc chiết xuất và ổn định do kích thước nhỏ và nhạy cảm với sự thay đổi nhiệt độ, áp suất và độ pH. Mặc dù nhiều nguồn và kỹ thuật để phân lập và ổn định đã được đề xuất, nhưng vẫn chưa có phương pháp nào được chấp nhận rộng rãi để phân lập và tinh chế chúng. 51 Exosome là các túi ngoại bào nhỏ do các loại tế bào tiết ra và là thành phần chính của giao tiếp tế bào và vận chuyển phân tử. Chúng chịu trách nhiệm cho giao tiếp giữa các tế bào rộng rãi dưới dạng các thành phần tế bào như protein, miRNA, axit nucleic và nhiều chất chuyển hóa khác nhau. 52
Lão hóa do ánh sáng, hậu quả của các yếu tố môi trường như tia cực tím và các tác nhân gây căng thẳng khác, ảnh hưởng đáng kể đến chất lượng da. Những tiến bộ y học gần đây tập trung vào tế bào gốc trung mô và RNA không mã hóa, có tiềm năng đầy hứa hẹn trong việc chống lại lão hóa do ánh sáng do dễ thu thập và có nhiều vai trò sinh lý khác nhau. Nghiên cứu của Li và cộng sự nêu bật triển vọng lâm sàng đáng kể của tế bào gốc và các dẫn xuất của chúng, bao gồm exosome và RNA không mã hóa, trong việc trẻ hóa làn da lão hóa và làm giảm tác động của lão hóa do ánh sáng. 53 Việc sử dụng exosome trực tiếp sau các phương pháp trẻ hóa da như laser phân đoạn, vi kim, vi kim tần số vô tuyến và mài da vi điểm hỗ trợ quá trình chữa lành. Phương pháp này giúp làm giảm các triệu chứng liên quan đến các thủ thuật này, bao gồm ban đỏ, phù nề và khó chịu. 51 Exosome đã được chứng minh là đẩy nhanh quá trình chuyển đổi từ giai đoạn phục hồi vết thương do viêm sang giai đoạn tái tạo bằng cách làm giảm biểu hiện của các yếu tố gây viêm. Nghiên cứu chỉ ra rằng exosome tế bào gốc trung mô ảnh hưởng đến sự phân cực của đại thực bào bằng cách nhắm mục tiêu vào PKNOX1. Hành động này dẫn đến việc giảm biểu hiện của các yếu tố gây viêm như interleukin-10 và yếu tố hoại tử khối u-alpha, kiểm soát hiệu quả phản ứng viêm. 54 Exosome đóng vai trò quan trọng trong giao tiếp tế bào bên trong lớp biểu bì, ảnh hưởng đáng kể đến hành vi của tế bào sừng. Các túi ngoại bào nhỏ này tạo điều kiện cho việc vận chuyển protein, lipid và RNA giữa các tế bào, do đó ảnh hưởng đến nhiều chức năng khác nhau của tế bào. Chúng thực hiện như vậy bằng cách thúc đẩy sự gắn kết và phân tầng tế bào, những yếu tố cần thiết cho hàng rào da mạnh mẽ và hiệu quả. 55 Hành vi của tế bào sừng, loại tế bào chiếm ưu thế trong lớp biểu bì, cũng bị ảnh hưởng đáng kể bởi exosome. Các túi này hỗ trợ điều chỉnh sự tăng sinh và biệt hóa của tế bào sừng, các quá trình cơ bản để duy trì tính toàn vẹn về cấu trúc và chức năng của lớp biểu bì. Thông qua việc truyền các tín hiệu phân tử cụ thể, exosome hướng dẫn các tế bào này phản ứng phù hợp với các kích thích môi trường khác nhau, do đó góp phần vào khả năng thích ứng của da. 56
Exosome đóng vai trò là chất truyền tin chính trong lớp hạ bì, ảnh hưởng đáng kể đến hành vi của nguyên bào sợi, các tế bào chủ yếu chịu trách nhiệm sản xuất collagen và elastin. Hai loại protein này rất quan trọng để duy trì độ đàn hồi và sức mạnh của da. Exosome tạo điều kiện thuận lợi cho sự giao tiếp giữa các tế bào da và chức năng của nguyên bào sợi, tăng cường tổng hợp collagen và elastin, và tăng chất béo ở lớp hạ bì, do đó thúc đẩy khả năng tái tạo và phục hồi để chống lão hóa da. Điều này dẫn đến kết cấu da được cải thiện và giảm sự xuất hiện của nếp nhăn và nếp nhăn nhỏ. Exosome cũng đóng vai trò trong việc sản xuất elastin, đặc tính đàn hồi này rất cần thiết để duy trì vẻ ngoài trẻ trung và săn chắc của làn da. 57 Ở cấp độ phân tử, exosome phát huy tác dụng trẻ hóa của chúng thông qua nhiều con đường và GF khác nhau, đặc biệt là TGF-B. Nó đóng vai trò quan trọng trong việc phục hồi và trẻ hóa da, ảnh hưởng đến sự phát triển, tăng sinh và biệt hóa của tế bào. Exosome mang và vận chuyển TGF-B đến các tế bào mục tiêu trong da, do đó kích hoạt các chuỗi tín hiệu cụ thể dẫn đến cải thiện cấu trúc và chức năng của da. 57 , 58 Hơn nữa, exosome tham gia vào quá trình điều biến ECM, một mạng lưới phức tạp gồm các protein và các phân tử khác cung cấp hỗ trợ về mặt cấu trúc và sinh hóa cho các tế bào xung quanh. Chúng hỗ trợ quá trình tái tạo ma trận này, một quá trình đặc biệt quan trọng trong quá trình chữa lành vết thương và ngăn ngừa hình thành sẹo. 59 Gần đây, người ta ngày càng chú trọng đến exosome có nguồn gốc từ hầu họng của con người (Exodew, Hyundaimeditech Inc, Hàn Quốc). Các tế bào gốc được thu thập thông qua lấy mẫu bằng tăm bông trong các kỳ thi như cúm từ thời thơ ấu được biết đến với khả năng biệt hóa đặc biệt của chúng (Hình 6 ).
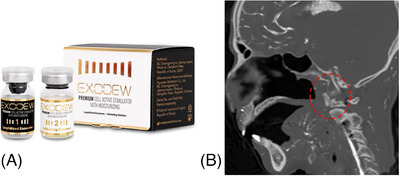
Gần đây, người ta ngày càng chú trọng đến các exosome có nguồn gốc từ hầu họng của con người (Exodew, Hyundaimeditech Inc., Hàn Quốc) (A). Các tế bào gốc được thu thập thông qua lấy mẫu bằng tăm bông trong quá trình kiểm tra hầu họng (có chấm đỏ), chẳng hạn như bệnh cúm ở trẻ nhỏ, được công nhận vì khả năng biệt hóa đáng chú ý của chúng (B).
2.7. Bộ phận tiết dịch
Secretome đề cập đến bộ sưu tập toàn diện các thành phần hòa tan mà một tế bào giải phóng vào môi trường xung quanh. Điều này bao gồm nhiều phân tử khác nhau như GF, cytokine và peptide, cũng như các hạt không hòa tan như túi ngoại bào và exosome. Các nguyên bào sợi da được biết là tiết ra một loạt các GF, cytokine và exosome đa dạng, đóng vai trò là chất trung gian thiết yếu của quá trình giao tiếp với các tế bào lân cận để hỗ trợ và tạo điều kiện cho việc duy trì và sửa chữa ECM. Đáng chú ý, một số sản phẩm được quảng cáo là “yếu tố tăng trưởng” thực chất là các sản phẩm secretome, bao gồm exosome. Những tiến bộ khoa học gần đây đã làm sáng tỏ vai trò quan trọng của các túi ngoại bào, đặc biệt là exosome, trong các quá trình giao tiếp tế bào phức tạp liên quan đến nhiều chức năng sinh học khác nhau, bao gồm chữa lành vết thương và phục hồi da. 51 , 60
Secretome có thể được lấy từ nhiều nguồn khác nhau, bao gồm tủy xương, mô mỡ, mô sơ sinh, mô da và máu ngoại vi. Chúng đã được chứng minh là có thể tăng cường sự di chuyển và tăng sinh của nhiều tế bào da khác nhau, bao gồm nguyên bào sợi, tế bào nội mô và tế bào sừng, và lớp biểu bì. 61 Các nghiên cứu trên động vật cho thấy secretome làm giảm sự hình thành nếp nhăn, cải thiện độ ẩm của da và tăng tổng hợp collagen dựa trên phân tích Masson-trichrome. 62 , 63
Khả năng của secretome và exosome tác động đến các quá trình tế bào quan trọng nhấn mạnh tiềm năng của chúng trong việc thúc đẩy chăm sóc da và các phương pháp điều trị da liễu. Phương pháp tiếp cận sáng tạo này đang cách mạng hóa các phương pháp điều trị chăm sóc da cá nhân hóa và các thủ thuật thẩm mỹ không xâm lấn, cung cấp các phương pháp thay thế hiệu quả hơn so với các phương thức khác. Việc tích hợp các công nghệ sinh học phân tử này biểu thị một sự thay đổi quan trọng hướng tới các phương pháp tiếp cận tinh vi hơn, có mục tiêu hơn và tự nhiên hơn trong các liệu pháp da liễu và cải thiện thẩm mỹ.
2.8. Chitosan
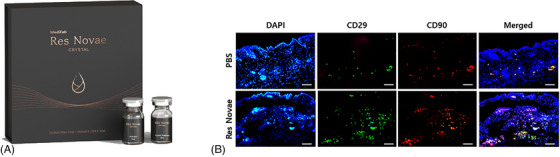
Chitosan là một polysaccharides được chiết xuất từ cua và nấm, và nhiều nghiên cứu đã được tiến hành trên các tín hiệu tế bào khác nhau trong tế bào gốc, tiểu cầu và tế bào miễn dịch, và tái tạo mô. 64 , 65 , 66 Một trong những cơ chế tái tạo chính của chitosan là thúc đẩy sự tăng sinh và biệt hóa của tế bào gốc. Đặc biệt, người ta biết rằng bằng cách điều chỉnh tăng biểu hiện của yếu tố-1α có nguồn gốc từ mô đệm, nó thúc đẩy sự định cư của tế bào gốc và sự hình thành mạch máu, do đó tăng cường sự tái tạo. 67Issaragrisil và cộng sự đã báo cáo rằng chitosan thúc đẩy sự phát triển và biệt hóa của thân trung mô ở người và khả năng tăng cường di chuyển của tế bào gốc đã được xác định trong ống nghiệm. 68Wang và cộng sự đã nghiên cứu sự hình thành mạch máu của hydrogel chitosan và khả năng tái tạo mô của nó. Họ đã so sánh hiệu quả trong mô hình nhồi máu cơ tim thiếu máu cục bộ với tế bào gốc có nguồn gốc từ mô mỡ và cho thấy hydrogel chitosan tạo ra mạch máu mới và ức chế xơ hóa ở mức độ tương tự như tế bào gốc có nguồn gốc từ mô mỡ. 69Dựa trên chức năng sinh học của vật liệu chitosan, một nghiên cứu đã được công bố về việc ứng dụng chitosan vào chất làm đầy da tái tạo. Park và cộng sự đã áp dụng công nghệ chuyển chất lỏng thành gel để tạo thành vật liệu chitosan dạng lỏng thành gel trong mô da và công bố rằng vật liệu này có độ bền cao sau khi tiêm vào da và thúc đẩy sản xuất collagen so với chất làm đầy HA. 70Res Novae của Medifab là chất tăng cường da dựa trên carboxymethyl chitosan với cơ chế tái tạo nêu trên. Họ đã chứng minh rằng chất tăng cường da carboxymethyl chitosan với công nghệ dạng lỏng thành gel đã tuyển dụng tế bào gốc trung mô CD29+ trong mô da (Hình 7 ).
Xét đến các cơ chế trên, người ta hy vọng rằng vật liệu chitosan có thể được sử dụng như một vật liệu tái tạo mới giúp tăng cường tái tạo mô da bằng cách kích hoạt các tế bào gốc nội tại.
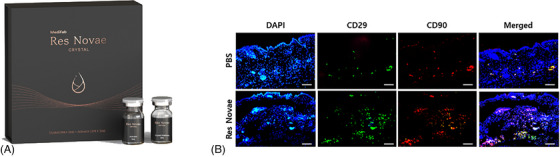
Thuốc tăng cường da đầu tiên dựa trên Kitosan, Res Novae (Medifab Inc., Hàn Quốc) (A), đã được phát hành và một nghiên cứu gần đây phát hiện ra rằng Kitosan đã tuyển dụng tế bào gốc trung mô CD29+ vào mô da của chuột không lông SKH vào ngày 1 sau khi tiêm nội bì (B). Thanh tỷ lệ: 100 μm. DAPI, 4′,6′-diamidino-2-phenylindole; PBS, dung dịch đệm phosphate.
2.9. Độc tố Botulinum
Việc pha loãng quá mức với việc đưa BoNT vào trong da, đôi khi được gọi là “microbotox” hoặc “babybotox”, đã được chứng minh là có tác dụng trẻ hóa da mặt. 71 , 72 Một số nghiên cứu đã chỉ ra những lợi ích của việc sử dụng BoNT để cải thiện tình trạng đỏ bừng mặt và ban đỏ. 73 , 74 , 75 Việc ức chế GF nội mô mạch máu, một yếu tố sinh mạch chính, biểu hiện bằng BoNT được coi là một cơ chế có thể. 76 Một nghiên cứu có đối chứng trên khuôn mặt chia đôi của Sayed và cộng sự đã báo cáo rằng sản xuất bã nhờn và kích thước lỗ chân lông giảm đáng kể sau khi tiêm BoNT vào trong da và kết quả kéo dài tới 4 tháng sau khi điều trị. 77 Hơn nữa, việc tăng sản xuất collagen bằng cách tiêm BoNT đã được nghiên cứu và cho thấy kết quả khả quan. 71 Có vẻ như lắng đọng collagen nhiều hơn thông qua vết nhuộm Masson trichrome khi kiểm tra mô học 2 tháng sau khi tiêm BoNT vào trong da loại A (BoNT-A) trong nghiên cứu của Chang và cộng sự. 78 Nó ảnh hưởng đến sự tương tác giữa acetylcholine và các thụ thể của nó (thụ thể acetylcholine nicotinic alpha 3; thụ thể acetylcholine nicotinic alpha 7) trong nguyên bào sợi để điều chỉnh cân bằng collagen. 79 , 80
Điều thú vị là các nghiên cứu lâm sàng gần đây đã báo cáo những tác động tích cực của BoNT-A lên sắc tố da. 81 , 82 Nó được chứng minh là có thể chấm dứt sắc tố da do tia cực tím gây ra bằng cách ức chế hoạt động của tyrosinase và hoạt động của tế bào hắc tố. Jung và cộng sự đã nghiên cứu sự thâm nhập nội bào của BoNT trong tế bào hắc tố biểu bì của người được nuôi cấy và tế bào sừng biểu bì của người. Nghiên cứu cho thấy tế bào hắc tố và tế bào sừng biểu hiện sự hấp thụ BoNT và cho thấy khả năng ức chế sản xuất melanin biểu bì. 83
Về mặt ứng dụng lâm sàng, BoNT nên được đưa vào da dưới dạng các giọt có kích thước đồng đều để có kết quả hiệu quả. Pha loãng quá mức với liều lượng tối thiểu được sử dụng cho tình trạng này. Tuy nhiên, nếu liều lượng quá ít, nó sẽ tạo ra kết quả không đủ, trong khi liều lượng quá cao có thể tạo ra kết quả không mong muốn do tác động không mong muốn đến các sợi cơ mặt sâu hơn. Kỹ thuật tiêm đòi hỏi phải sử dụng kim 30 hoặc 32 G, tạo ra một nốt nhỏ của sản phẩm với 0,03–0,05 mL thành nhiều giọt nhỏ trên mỗi điểm với khoảng cách 0,8–1,0 cm theo kiểu lưới. Thời gian tác dụng thường duy trì trong 1–3 tháng. Hơn nữa, việc sử dụng BoNT có lợi hơn để trẻ hóa da là nó có thể được trộn với các chất tiêm khác được gọi là “mesococktails” để tối ưu hóa kết quả điều trị mà không làm mất hiệu quả của từng sản phẩm. 84 BoNT có thể mang lại kết quả đầy hứa hẹn để cải thiện chất lượng da và trẻ hóa khuôn mặt. Một số khía cạnh của chất lượng da tốt có thể đạt được bằng cách tiêm BoNT-A vào da. Nó mang lại hiệu quả về mặt chi phí, tác dụng phụ tối thiểu và thời gian tác dụng hợp lý. Hơn nữa, nó có thể tích hợp với các phương thức khác cũng như khả năng tạo ra các chất tiêm kết hợp để tăng cường kết quả điều trị. Không có gì ngạc nhiên khi BoNT-A được sử dụng rộng rãi trong một số chỉ định thẩm mỹ.
3. Skin booter: Bàn luận
Một yếu tố quan trọng trong việc tối ưu hóa hiệu quả của chất tăng cường da liên quan đến việc đưa các thành phần hoạt tính hiệu quả qua hàng rào bảo vệ của da. Thách thức nằm ở việc tìm ra các phương pháp tạo điều kiện cho các thành phần thẩm thấu vào các lớp hạ bì mà không gây khó chịu.
Có thể sử dụng một số phương pháp để đạt được điều này, bao gồm các kỹ thuật tiêm như mesotherapy, iontophoresis, điện di, vi kim, kim tần số cao, siêu âm, laser, plasma và cung cấp thuốc qua da bằng kim tiêm không kim. Phương pháp cung cấp được lựa chọn cũng quan trọng như việc lựa chọn chất tăng cường da. 85 , 86
Ví dụ, trước đây, tiêm dưới da PDLA, một loại polymer, thường được thực hiện bằng cách tiêm kim. Tuy nhiên, với sự tiến bộ của các kỹ thuật châm cứu vi xâm lấn, tiêm dưới da hiện có thể thực hiện được thông qua các phương pháp kiểm soát dựa trên máy.
Khi tiêm chất tăng cường da vào da, quá trình này thường liên quan đến việc sử dụng kim hoặc áp dụng áp lực cơ học để đưa chất tiêm vào mô. Các tác động phát sinh từ các bước thủ thuật này cần được cân nhắc kỹ lưỡng. Các nghiên cứu về tác động của kích thích mô da do kim gây ra đã làm sáng tỏ các tác động của kích thích cơ học lên tế bào nguyên bào sợi. Ví dụ, nghiên cứu của Langevin đã làm nổi bật ảnh hưởng của kim lên các mô tại chỗ và tác động của chúng lên tế bào nguyên bào sợi (Hình 8 ). 87 Người ta lưu ý rằng các lực bên ngoài tác động lên tế bào có thể dẫn đến co tế bào, do đó gây căng thẳng lên nguyên bào sợi, ảnh hưởng đến nhiều quá trình chuyển hóa tế bào. Ngoài ra, các thí nghiệm do Langevin thực hiện vào năm 2006 88 đã chứng minh rằng hoạt động của tế bào nguyên bào sợi tăng lên khi kim, sau khi đâm xuyên qua mô dưới da, được xoắn thử nghiệm (Hình 9 và 10 ). Điều này minh họa cách riêng kích thích cơ học có khả năng điều chỉnh hoạt động của tế bào nguyên bào sợi trong các điều kiện lâm sàng. Những phát hiện như vậy không chỉ có thể áp dụng cho các thủ thuật liên quan đến việc đâm kim vào da mà còn cho nhiều can thiệp khác sử dụng các chất tiêm.
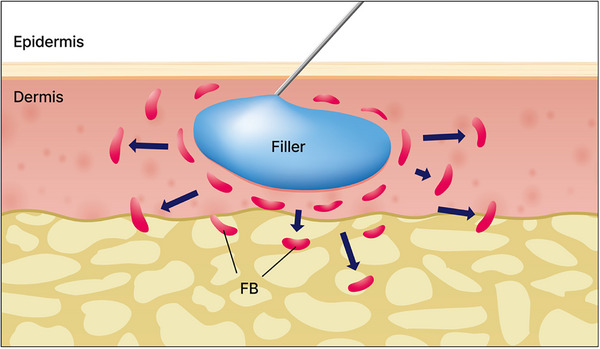
Các nghiên cứu về tác động của kích thích mô da do kim gây ra đã làm sáng tỏ tác động của kích thích cơ học lên tế bào nguyên bào sợi. Ví dụ, nghiên cứu của Langevin đã làm nổi bật ảnh hưởng của kim lên mô tại chỗ và tác động của chúng lên tế bào nguyên bào sợi. FB, Tế bào nguyên bào sợi, FB.
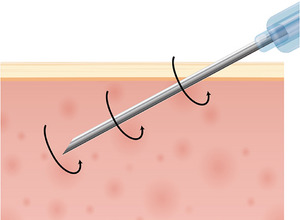
Thí nghiệm của Langevin chứng minh hoạt động của tế bào nguyên bào sợi tăng lên khi kim, sau khi xuyên qua mô dưới da, được xoắn thử nghiệm.
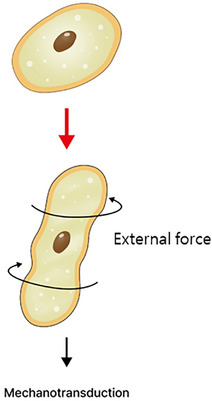
Thông qua quá trình chuyển hóa cơ học, các tế bào nhận được tín hiệu đến tế bào chất và nhân tế bào thông qua sự biến dạng của thành tế bào. Quá trình này gửi tín hiệu đến nhân tế bào để phân biệt tế bào, phân chia, tăng trưởng, tổng hợp protein và bắt đầu quá trình tái tạo bộ khung tế bào.
Tóm lại, thuật ngữ “chất tăng cường làn da” trước đây chưa có phạm vi định nghĩa cụ thể, nhưng nó bao gồm rộng rãi tất cả các chất khi tiêm hoặc thoa để thẩm thấu vào lớp hạ bì sẽ ảnh hưởng đến quá trình trẻ hóa da.
Tài liệu tham khảo(REFERENCES)
- 1. Landau M, Fagien S. Science of hyaluronic acid beyond filling: fibroblasts and their response to the extracellular matrix. Plast Reconstr Surg. 2015;136(suppl 5):188S‐195S. doi: 10.1097/PRS.0000000000001823 [DOI] [PubMed] [Google Scholar]
- 2. Gao YR, Wang RP, Zhang L, et al. Oral administration of hyaluronic acid to improve skin conditions via a randomized double‐blind clinical test. Skin Res Technol. 2023;29(11):e13531. doi: 10.1111/srt.13531 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Wang F, Garza LA, Kang S, et al. In vivo stimulation of de novo collagen production caused by cross‐linked hyaluronic acid dermal filler injections in photodamaged human skin. Arch Dermatol. 2007;143(2):155‐163. doi: 10.1001/archderm.143.2.155 [DOI] [PubMed] [Google Scholar]
- 4. Yi KH, Lee JJ, Hur HW, Bae H, Kim HJ. Hyaluronic acid filler injection for deep nasolabial folds: a novel intraoral approach. Clin Anat. 2022;35(6):820‐823. Epub 20220614. doi: 10.1002/ca.23919 [DOI] [PubMed] [Google Scholar]
- 5. Chen F, Guo X, Wu Y. Skin antiaging effects of a multiple mechanisms hyaluronan complex. Skin Res Technol. 2023;29(6):e13350. doi: 10.1111/srt.13350 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Hertz‐Kleptow D, Hanschmann A, Hofmann M, Reuther T, Kerscher M. Facial skin revitalization with CPM(®)‐HA20G: an effective and safe early intervention treatment. Clin Cosmet Investig Dermatol. 2019;12:563‐572. Epub 20190813. doi: 10.2147/ccid.S209256 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Kleine‐Börger L, Hofmann M, Kerscher M. Microinjections with hyaluronic acid in combination with glycerol: how do they influence biophysical viscoelastic skin properties? Skin Res Technol. 2022;28(4):633‐642. doi: 10.1111/srt.13167 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Schwartz J, Friedman AJ. Exogenous factors in skin barrier repair. J Drugs Dermatol. 2016;15(11):1289‐1294. PubMed PMID: 28095538 [PubMed] [Google Scholar]
- 9. Fluhr J, Bornkessel A, Berardesca E. Glycerol—just a moisturizer? Biological and biophysical effects. Dry Skin and Moisturizers (pp. 227‐243). CRC Press; 2005. [Google Scholar]
- 10. Heidemann W, Jeschkeit S, Ruffieux K, et al. Degradation of poly(D,L)lactide implants with or without addition of calciumphosphates in vivo. Biomaterials. 2001;22(17):2371‐2381. doi: 10.1016/s0142-9612(00)00424-5 [DOI] [PubMed] [Google Scholar]
- 11. Belmontesi M, De Angelis F, Di Gregorio C, et al. Injectable non‐animal stabilized hyaluronic acid as a skin quality booster: an expert panel consensus. J Drugs Dermatol. 2018;17(1):83‐88. PubMed PMID: 29320592 [PubMed] [Google Scholar]
- 12. Iqbal N. Recent concepts in biodegradable polymers for tissue engineering paradigms: a critical review. Int Mater Rev. 2018;64:91‐126. doi: 10.1080/09506608.2018.1460943 [DOI] [Google Scholar]
- 13. Sit RW, Chung V, Reeves KD, et al. Hypertonic dextrose injections (prolotherapy) in the treatment of symptomatic knee osteoarthritis: a systematic review and meta‐analysis. Sci Rep. 2016;6:25247. Epub 20160505. doi: 10.1038/srep25247 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. de Luca Brunori I, Battini L, Filippeschi M, Romani L, Tarani A, Urbano M. [Topical therapy with placental polydeoxyribonucleotide in cervical ectopy and ectropion]. Ann Ostet Ginecol Med Perinat. 1989;110(1):35‐41. PubMed PMID: 2757327 [PubMed] [Google Scholar]
- 15. Perino A, Genova G, Vita C, et al. The pharmacologic therapy of post‐cauterization and post‐laser vaporization with polydeoxyribonucleotide. Ann Ostet Ginecol Med Perinat. 1990;111(6):372‐378. PubMed PMID: 2102064 [PubMed] [Google Scholar]
- 16. Muratore O, Pesce Schito A, Cattarini G, et al. Evaluation of the trophic effect of human placental polydeoxyribonucleotide on human knee skin fibroblasts in primary culture. Cell Mol Life Sci. 1997;53(3):279‐285. doi: 10.1007/pl00000605 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Thellung S, Florio T, Maragliano A, Cattarini G, Schettini G. Polydeoxyribonucleotides enhance the proliferation of human skin fibroblasts: involvement of A2 purinergic receptor subtypes. Life Sci. 1999;64(18):1661‐1674. doi: 10.1016/s0024-3205(99)00104-6 [DOI] [PubMed] [Google Scholar]
- 18. Valdatta L, Thione A, Mortarino C, Buoro M, Tuinder S. Evaluation of the efficacy of polydeoxyribonucleotides in the healing process of autologous skin graft donor sites: a pilot study. Curr Med Res Opin. 2004;20(3):403‐408. doi: 10.1185/030079904125003116 [DOI] [PubMed] [Google Scholar]
- 19. Rubegni P, De Aloe G, Mazzatenta C, Cattarini L, Fimiani M. Clinical evaluation of the trophic effect of polydeoxyribonucleotide (PDRN) in patients undergoing skin explants. A pilot study. Curr Med Res Opin. 2001;17(2):128‐131. PubMed PMID: 11759182 [PubMed] [Google Scholar]
- 20. Kim DS, Lee JK, Kim JH, et al. Advanced PLGA hybrid scaffold with a bioactive PDRN/BMP2 nanocomplex for angiogenesis and bone regeneration using human fetal MSCs. Sci Adv. 2021;7(50):eabj1083. Epub 20211208. doi: 10.1126/sciadv.abj1083 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Guizzardi S, Galli C, Govoni P, et al. Polydeoxyribonucleotide (PDRN) promotes human osteoblast proliferation: a new proposal for bone tissue repair. Life Sci. 2003;73(15):1973‐1983. doi: 10.1016/s0024-3205(03)00547-2 [DOI] [PubMed] [Google Scholar]
- 22. Altavilla D, Bitto A, Polito F, et al. Polydeoxyribonucleotide (PDRN): a safe approach to induce therapeutic angiogenesis in peripheral artery occlusive disease and in diabetic foot ulcers. Cardiovasc Hematol Agents Med Chem. 2009;7(4):313‐321. doi: 10.2174/187152509789541909 [DOI] [PubMed] [Google Scholar]
- 23. Galeano M, Bitto A, Altavilla D, et al. Polydeoxyribonucleotide stimulates angiogenesis and wound healing in the genetically diabetic mouse. Wound Repair Regen. 2008;16(2):208‐217. doi: 10.1111/j.1524-475X.2008.00361.x [DOI] [PubMed] [Google Scholar]
- 24. Belletti S, Uggeri J, Gatti R, Govoni P, Guizzardi S. Polydeoxyribonucleotide promotes cyclobutane pyrimidine dimer repair in UVB‐exposed dermal fibroblasts. Photodermatol Photoimmunol Photomed. 2007;23(6):242‐249. doi: 10.1111/j.1600-0781.2007.00320.x [DOI] [PubMed] [Google Scholar]
- 25. Kim YJ, Kim MJ, Kweon DK, Lim ST, Lee SJ. Polydeoxyribonucleotide activates mitochondrial biogenesis but reduces MMP‐1 activity and melanin biosynthesis in cultured skin cells. Appl Biochem Biotechnol. 2020;191(2):540‐554. Epub 20191207. doi: 10.1007/s12010-019-03171-2 [DOI] [PubMed] [Google Scholar]
- 26. Noh TK, Chung BY, Kim SY, et al. Novel anti‐melanogenesis properties of polydeoxyribonucleotide, a popular wound healing booster. Int J Mol Sci. 2016;17(9):1448. Epub 20160901. doi: 10.3390/ijms17091448 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Lee SH, Yoo SH, Lee HJ, et al. Anti‐allodynic effects of polydeoxyribonucleotide in an animal model of neuropathic pain and complex regional pain syndrome. J Korean Med Sci. 2020;35(26):e225. Epub 20200706. doi: 10.3346/jkms.2020.35.e225 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Mannino F, Pallio G, Bitto A, et al. Targeting adenosine receptor by polydeoxyribonucleotide: an effective therapeutic strategy to induce white‐to‐brown adipose differentiation and to curb obesity. Pharmaceuticals (Basel). 2021;14(8):728. Epub 20210727. doi: 10.3390/ph14080728 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Park KY, Seok J, Rho NK, Kim BJ, Kim MN. Long‐chain polynucleotide filler for skin rejuvenation: efficacy and complications in five patients. Dermatol Ther. 2016;29(1):37‐40. Epub 20151102. doi: 10.1111/dth.12299 [DOI] [PubMed] [Google Scholar]
- 30. Kim JH, Jeong JJ, Lee YI, et al. Preventive effect of polynucleotide on post‐thyroidectomy scars: a randomized, double‐blinded, controlled trial. Lasers Surg Med. 2018:755‐762. Epub 20180325. doi: 10.1002/lsm.22812 [DOI] [PubMed] [Google Scholar]
- 31. Lee YJ, Kim HT, Lee YJ, et al. Comparison of the effects of polynucleotide and hyaluronic acid fillers on periocular rejuvenation: a randomized, double‐blind, split‐face trial. J Dermatolog Treat. 2022;33(1):254‐260. Epub 20200406. doi: 10.1080/09546634.2020.1748857 [DOI] [PubMed] [Google Scholar]
- 32. Kim MJ, Park HJ, Oh SM, Yi KH. Polynucleotide injection treatment for iatrogenic fat atrophy in two patients: potential for safe volumization in aesthetic medicine. Skin Res Technol. 2023;29(8):e13439. doi: 10.1111/srt.13439 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Lee D, Kim MJ, Park HJ, et al. Current practices and perceived effectiveness of polynucleotides for treatment of facial erythema by cosmetic physicians. Skin Res Technol. 2023;29(9):e13466. doi: 10.1111/srt.13466 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Alves R, Grimalt R. A review of platelet‐rich plasma: history, biology, mechanism of action, and classification. Skin Appendage Disord. 2018;4(1):18‐24. Epub 20170706. doi: 10.1159/000477353 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35. Garraud O, Tariket S, Sut C, et al. Transfusion as an inflammation hit: knowns and unknowns. Front Immunol. 2016;7:534. Epub 20161129. doi: 10.3389/fimmu.2016.00534 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Lin MY, Lin CS, Hu S, Chung WH. Progress in the use of platelet‐rich plasma in aesthetic and medical dermatology. J Clin Aesthet Dermatol. 2020;13(8):28‐35. Epub 20200801. PubMed PMID: 33178379; PubMed Central PMCID: PMC7595356 [PMC free article] [PubMed] [Google Scholar]
- 37. Nanda S, Chauhan K, Shetty V, Dashore S, Bhatia S. Platelet‐rich plasma in aesthetics. Indian Dermatol Online J. 2021;12(Suppl 1):S41‐S54. Epub 20211125. doi: 10.4103/idoj.idoj_290_21 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. Knighton DR, Hunt TK, Thakral KK, Goodson WH, 3rd. Role of platelets and fibrin in the healing sequence: an in vivo study of angiogenesis and collagen synthesis. Ann Surg. 1982;196(4):379‐388. doi: 10.1097/00000658-198210000-00001 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Kawazoe T, Kim HH. Tissue augmentation by white blood cell‐containing platelet‐rich plasma. Cell Transplant. 2012;21(2‐3):601‐607. doi: 10.3727/096368911×605538 [DOI] [PubMed] [Google Scholar]
- 40. Cameli N, Mariano M, Cordone I, Abril E, Masi S, Foddai ML. Autologous pure platelet‐rich plasma dermal injections for facial skin rejuvenation: clinical, instrumental, and flow cytometry assessment. Dermatol Surg. 2017;43(6):826‐835. doi: 10.1097/dss.0000000000001083 [DOI] [PubMed] [Google Scholar]
- 41. Alam M, Hughart R, Champlain A, et al. Effect of platelet‐rich plasma injection for rejuvenation of photoaged facial skin: a Randomized Clinical Trial. JAMA Dermatol. 2018;154(12):1447‐1452. doi: 10.1001/jamadermatol.2018.3977 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42. Abuaf OK, Yildiz H, Baloglu H, Bilgili ME, Simsek HA, Dogan B. Histologic evidence of new collagen formulation using platelet rich plasma in skin rejuvenation: a prospective controlled clinical study. Ann Dermatol. 2016;28(6):718‐724. Epub 20161123. doi: 10.5021/ad.2016.28.6.718 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43. Kim DH, Je YJ, Kim CD, et al. Can platelet‐rich plasma be used for skin rejuvenation? Evaluation of effects of platelet‐rich plasma on human dermal fibroblast. Ann Dermatol. 2011;23(4):424‐431. Epub 20111103. doi: 10.5021/ad.2011.23.4.424 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44. Hofny ERM, Abdel‐Motaleb AA, Ghazally A, Ahmed AM, Hussein MRA. Platelet‐rich plasma is a useful therapeutic option in melasma. J Dermatolog Treat. 2019;30(4):396‐401. Epub 20181129. doi: 10.1080/09546634.2018.1524821 [DOI] [PubMed] [Google Scholar]
- 45. Tracy LE, Minasian RA, Caterson EJ. Extracellular matrix and dermal fibroblast function in the healing wound. Adv Wound Care (New Rochelle). 2016;5(3):119‐136. doi: 10.1089/wound.2014.0561 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46. Merchan WH, Gomez LA, Chasoy ME, Alfonso‐Rodriguez CA, Munoz AL. Platelet‐rich plasma, a powerful tool in dermatology. J Tissue Eng Regen Med. 2019;13(5):892‐901. Epub 20190409. doi: 10.1002/term.2832 [DOI] [PubMed] [Google Scholar]
- 47. Barrientos S, Brem H, Stojadinovic O, Tomic‐Canic M. Clinical application of growth factors and cytokines in wound healing. Wound Repair Regen. 2014;22(5):569‐578. doi: 10.1111/wrr.12205 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48. Yun WJ, Bang SH, Min KH, Kim SW, Lee MW, Chang SE. Epidermal growth factor and epidermal growth factor signaling attenuate laser‐induced melanogenesis. Dermatol Surg. 2013;39(12):1903‐1911. Epub 20131017. doi: 10.1111/dsu.12348 [DOI] [PubMed] [Google Scholar]
- 49. Lyons A, Stoll J, Moy R. A randomized, double‐blind, placebo‐controlled, split‐face study of the efficacy of topical epidermal growth factor for the treatment of melasma. J Drugs Dermatol. 2018;17(9):970‐973. PubMed PMID: 30235384 [PubMed] [Google Scholar]
- 50. Choi J‐K, Chung H, Oh SJ, Kim J‐W, Kim S‐H. Functionally enhanced cell spheroids for stem cell therapy: Role of TIMP1 in the survival and therapeutic effectiveness of stem cell spheroids. Acta Biomaterialia 2023;166:454‐469. 10.1016/j.actbio.2023.05.033 [DOI] [PubMed] [Google Scholar]
- 51. Zhang B, Gong J, He L, Khan A, Xiong T, Shen H, et al. Exosomes based advancements for application in medical aesthetics. Front Bioeng Biotechnol. 2022;10:1083640. Epub 20221220. doi: 10.3389/fbioe.2022.1083640 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52. Olumesi KR, Goldberg DJ. A review of exosomes and their application in cutaneous medical aesthetics. J Cosmet Dermatol. 2023;22(10):2628‐2634. Epub 20230727. doi: 10.1111/jocd.15930 [DOI] [PubMed] [Google Scholar]
- 53. Li KJ, Zhou PJ, Guo YN, et al. Recent advances in exosomal non‐coding RNA‐based therapeutic approaches for photoaging. Skin Res Technol. 2023;29:e13463. doi: 10.1111/srt.13463 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54. Yi K‐H, Park M‐S, Ree Y‐S, Kim HM. A review on “Skin Boosters”: hyaluronic acid, poly‐L‐lactic acid and pol‐D‐lactic acid, polydeoxyribonucleotide, polynucleotides, growth factor, and exosome. Aesthet. 2023;4(1):6. Epub 2023/04/30. doi: 10.46738/Aesthetics.2023.4.1.2 [DOI] [Google Scholar]
- 55. Wu JY, Wu SN, Zhang LP, et al. Stem cell‐derived exosomes: a new method for reversing skin aging. Tissue Eng Regen Med. 2022;19(5):961‐968. Epub 20220709. doi: 10.1007/s13770-022-00461-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56. Yang GH, Lee YB, Kang D, et al. Overcome the barriers of the skin: exosome therapy. Biomater Res. 2021;25(1):22. Epub 20210703. doi: 10.1186/s40824-021-00224-8 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57. Xiong M, Zhang Q, Hu W, et al. The novel mechanisms and applications of exosomes in dermatology and cutaneous medical aesthetics. Pharmacol Res. 2021;166:105490. Epub 20210212. doi: 10.1016/j.phrs.2021.105490 [DOI] [PubMed] [Google Scholar]
- 58. Liu Y, Wang H, Wang J. Exosomes as a novel pathway for regulating development and diseases of the skin. Biomed Rep. 2018;8(3):207‐214. Epub 20180131. doi: 10.3892/br.2018.1054 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59. Hong P, Yang H, Wu Y, Li K, Tang Z. The functions and clinical application potential of exosomes derived from adipose mesenchymal stem cells: a comprehensive review. Stem Cell Res Ther. 2019;10(1):242. Epub 20190807. doi: 10.1186/s13287-019-1358-y [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60. Vyas KS, Kaufman J, Munavalli GS, Robertson K, Behfar A, Wyles SP. Exosomes: the latest in regenerative aesthetics. Regen Med. 2023;18(2):181‐194. Epub 20230104. doi: 10.2217/rme-2022-0134 [DOI] [PubMed] [Google Scholar]
- 61. Damayanti RH, Rusdiana T, Wathoni N. Mesenchymal stem cell secretome for dermatology application: a review. Clin Cosmet Investig Dermatol. 2021;14:1401‐1412. Epub 20211005. doi: 10.2147/ccid.S331044 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62. Li L, Ngo HTT, Hwang E, et al. Conditioned medium from human adipose‐derived mesenchymal stem cell culture prevents UVB‐induced skin aging in human keratinocytes and dermal fibroblasts. Int J Mol Sci. 2019;21(1):49. Epub 20191219. doi: 10.3390/ijms21010049 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63. Guo S, Wang T, Zhang S, et al. Adipose‐derived stem cell‐conditioned medium protects fibroblasts at different senescent degrees from UVB irradiation damages. Mol Cell Biochem. 2020;463(1‐2):67‐78. Epub 20191010. doi: 10.1007/s11010-019-03630-8 [DOI] [PubMed] [Google Scholar]
- 64. de Sousa Victor R, Marcelo da Cunha Santos A, Viana de Sousa B, de Araújo Neves G, Navarro de Lima Santana L, Rodrigues Menezes R. A review on Chitosan’s uses as biomaterial: tissue engineering, drug delivery systems and cancer treatment. Materials. 2020;13(21):4995. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65. Kim Y, Zharkinbekov Z, Raziyeva K, et al. Chitosan‐based biomaterials for tissue regeneration. Pharmaceutics. 2023;15(3):807. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66. Nanduri LSY. Chitosan––stem cell interactions. In: Chitosan for Biomaterials III: Structure‐Property Relationships. Springer; 2021:343‐359. [Google Scholar]
- 67. Farhadihosseinabadi B, Zarebkohan A, Eftekhary M, Heiat M, Moosazadeh Moghaddam M, Gholipourmalekabadi M. Crosstalk between chitosan and cell signaling pathways. Cell Mol Life Sci. 2019;76:2697‐2718. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68. Charoenwongpaiboon T, Supraditaporn K, Klaimon P, et al. Effect of alternan versus chitosan on the biological properties of human mesenchymal stem cells. RSC Adv. 2019;9(8):4370‐4379. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69. Liu Z, Wang H, Wang Y, et al. The influence of chitosan hydrogel on stem cell engraftment, survival and homing in the ischemic myocardial microenvironment. Biomaterials. 2012;33(11):3093‐3106. [DOI] [PubMed] [Google Scholar]
- 70. Kim JY, Kim SH, Choi MH, Lee SH, Cha M, Park JU. Novel chitosan dermal filler with enhanced moldability and elasticity. Macromol Biosci. 2022;22(8):2200081. [DOI] [PubMed] [Google Scholar]
- 71. Sun Y, Li Y, Zhang Y, et al. Unparallel improvement patterns of dynamic wrinkles and skin quality after botulinum toxin type A treatment on the upper face. Skin Res Technol. 2023;29(3):e13309. doi: 10.1111/srt.13309 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72. Jeon IK, Chang SE, Park GH, Roh MR. Comparison of microneedle fractional radiofrequency therapy with intradermal botulinum toxin a injection for periorbital rejuvenation. Dermatology. 2013;227(4):367‐372. Epub 20131121. doi: 10.1159/000356162 [DOI] [PubMed] [Google Scholar]
- 73. Kim MJ, Kim JH, Cheon HI, et al. Assessment of skin physiology change and safety after intradermal injections with botulinum toxin: a randomized, double‐blind, placebo‐controlled, split‐face pilot study in rosacea patients with facial erythema. Dermatol Surg. 2019;45(9):1155‐1162. doi: 10.1097/DSS.0000000000001819 [DOI] [PubMed] [Google Scholar]
- 74. Park KY, Hyun MY, Jeong SY, BJ Kim, Kim MN, Hong CK. Botulinum toxin for the treatment of refractory erythema and flushing of rosacea. Dermatology. 2015;230(4):299‐301. Epub 20150303. doi: 10.1159/000368773 [DOI] [PubMed] [Google Scholar]
- 75. Bloom BS, Payongayong L, Mourin A, Goldberg DJ. Impact of intradermal abobotulinumtoxinA on facial erythema of rosacea. Dermatol Surg. 2015;41(suppl 1):S9‐S16. doi: 10.1097/DSS.0000000000000277 [DOI] [PubMed] [Google Scholar]
- 76. Shie JH, Liu HT, Wang YS, Kuo HC. Immunohistochemical evidence suggests repeated intravesical application of botulinum toxin A injections may improve treatment efficacy of interstitial cystitis/bladder pain syndrome. BJU Int. 2013;111(4):638‐646. Epub 20120903. doi: 10.1111/j.1464-410X.2012.11466.x [DOI] [PubMed] [Google Scholar]
- 77. Sayed KS, Hegazy R, Gawdat HI, et al. The efficacy of intradermal injections of botulinum toxin in the management of enlarged facial pores and seborrhea: a split face‐controlled study. J Dermatolog Treat. 2021;32(7):771‐777. Epub 20200103. doi: 10.1080/09546634.2019.1708241 [DOI] [PubMed] [Google Scholar]
- 78. Chang SP, Tsai HH, Chen WY, Lee WR, Chen PL, Tsai TH. The wrinkles soothing effect on the middle and lower face by intradermal injection of botulinum toxin type A. Int J Dermatol. 2008;47(12):1287‐1294. doi: 10.1111/j.1365-4632.2008.03895.x [DOI] [PubMed] [Google Scholar]
- 79. Stegemann A, Raker V, Del Rey A, Steinbrink K, Bohm M. Expression of the alpha7 nicotinic acetylcholine receptor is critically required for the antifibrotic effect of PHA‐543613 on skin fibrosis. Neuroendocrinology. 2022;112(5):446‐456. Epub 20210611. doi: 10.1159/000517772 [DOI] [PubMed] [Google Scholar]
- 80. Arredondo J, Hall LL, Ndoye A, et al. Central role of fibroblast alpha3 nicotinic acetylcholine receptor in mediating cutaneous effects of nicotine. Lab Invest. 2003;83(2):207‐225. doi: 10.1097/01.lab.0000053917.46614.12 [DOI] [PubMed] [Google Scholar]
- 81. Yamauchi PS, Lask G, Lowe NJ. Botulinum toxin type A gives adjunctive benefit to periorbital laser resurfacing. J Cosmet Laser Ther. 2004;6(3):145‐148. doi: 10.1080/14764170410023767 [DOI] [PubMed] [Google Scholar]
- 82. Carruthers J, Carruthers A. The effect of full‐face broadband light treatments alone and in combination with bilateral crow’s feet Botulinum toxin type A chemodenervation. Dermatol Surg. 2004;30(3):355‐366. discussion 66. doi: 10.1111/j.1524-4725.2004.30101.x [DOI] [PubMed] [Google Scholar]
- 83. Jung JA, Kim BJ, Kim MS, et al. Protective effect of botulinum toxin against ultraviolet‐induced skin pigmentation. Plast Reconstr Surg. 2019;144(2):347‐356. doi: 10.1097/PRS.0000000000005838 [DOI] [PubMed] [Google Scholar]
- 84. Kandhari R, Kaur I, Sharma D. Mesococktails and mesoproducts in aesthetic dermatology. Dermatol Ther. 2020;33(6):e14218. Epub 20200910. doi: 10.1111/dth.14218 [DOI] [PubMed] [Google Scholar]
- 85. Kim JE, Hong JY, Lee HJ, Lee SY, Kim HJ. Picosecond‐domain fractional laser treatment over hyaluronic acid fillers: in vivo and clinical studies. Lasers Surg Med. 2020;52(10):928‐934. Epub 20200429. doi: 10.1002/lsm.23254 [DOI] [PubMed] [Google Scholar]
- 86. Lee JJ, Yi KH, Kim HS, et al. A novel needle‐free microjet drug injector using Er:YAG LASER: A completely new concept of trans‐dermal drug delivery system. Clin Anat. 2022;35:682‐685. doi: 10.1002/ca.23892 [DOI] [PubMed] [Google Scholar]
- 87. Langevin HM, Churchill DL, Wu J, et al. Evidence of connective tissue involvement in acupuncture. Faseb J. 2002;16(8):872‐874. Epub 20020410. doi: 10.1096/fj.01-0925fje [DOI] [PubMed] [Google Scholar]
- 88. Langevin HM, Bouffard NA, Badger GJ, Iatridis JC, Howe AK. Dynamic fibroblast cytoskeletal response to subcutaneous tissue stretch ex vivo and in vivo. Am J Physiol Cell Physiol. 2005;288(3):C747‐C756. Epub 20041020. doi: 10.1152/ajpcell.00420.2004 [DOI] [PubMed] [Google Scholar]
- 89. Zhang B, Gong J, He L, Khan A, Xiong T, Shen H, et al. Exosomes based advancements for application in medical aesthetics. Front Bioeng Biotechnol. 2022;10:1083640. Epub 20221220. [DOI] [PMC free article] [PubMed] [Google Scholar]

